Kemisk koncentration

- 3089
- 699
- Johan Gustafsson
 Kemisk koncentration är det som bestämmer andelen ett lösta ämnet och ett lösningsmedel i en kemisk lösning
Kemisk koncentration är det som bestämmer andelen ett lösta ämnet och ett lösningsmedel i en kemisk lösning Vad är kemisk koncentration?
De Kemisk koncentration Det är en egenskap hos lösningarna som representerar mängden lösta ämnen för varje lösningsenhet. Med andra ord, det är ett nummer som indikerar andelen i vilken lösta ämnet och lösningsmedlet finns.
Kom ihåg att en lösning är en homogen blandning bildad av ett lösningsmedel (generellt vätska) och ett eller flera ämnen upplöst i det lösningsmedel vi kallar lösta ämnen. Lösningarna kännetecknas av lösningsmedlet, lösta ämnet och koncentrationen.
Koncentrationen är en mycket användbar egenskapegenskap, eftersom det gör att vi kan beskriva dem. Om vi till exempel vet att koncentrationen av salt i havsvatten är 35 gram för varje liter, vet vi att vi i vårt hus upplöser 35 gram salt i en liter lösning, kommer vi att få en lika lösning av salt som havsvatten.
Egenskaper för kemisk koncentration
Det är en intensiv egendom
Detta är det huvudsakliga kännetecknet för koncentrationen. Intensivt innebär att det inte beror på hur mycket lösning vi har. Som ett exempel betyder detta att koncentrationen är densamma i en droppe havsvatten än i 100 liter av samma.
Kan variera med temperaturen
I allmänhet utvidgar eller ökar vätskorna sin volym vid uppvärmning. Detta gäller också för lösningar. Av denna anledning kan koncentrationerna som uttrycks beroende på volym förändras något vid uppvärmning eller kylning av lösningen.
Det kan täcka mycket brett sortiment
Oavsett enheter där en kemisk koncentration uttrycks kan den ha från relativt stora värden till extremt små värden.
Till exempel kan koncentrationen av en lösning uttryckt i procent har värden från 0% till 100%, vilket täcker många storleksordningar. Vi kunde förbereda en 90%-lösning, eftersom vi också kunde förbereda en av 10-12%, vilket är nästan 14 beställningar av mindre storlek.
Vad är kemisk koncentration för?
Att känna till koncentrationen av en lösning gör att vi kan beskriva den. Det finns många egenskaper hos lösningar som beror på deras koncentration. Till exempel beror smält- och kokpunkten på koncentrationen, så att vi vet att det gör att vi kan beräkna dessa två egenskaper.
Kan tjäna dig: glasartillståndÅ andra sidan tillåter koncentration oss att enkelt jämföra en lösning med en annan. Om vi har två vattenlösningar med socker kan vi veta att deras koncentrationer kan veta vilken av de två som är sötare.
Dessutom beror alla kemiska reaktioner som möjliggör livet starkt på koncentrationen av oändliga lösta ämnen i celler och omgivningen av levande varelser.
Till exempel bestämmer koncentrationen av syre i luften om en person kommer att kvävas eller inte; PH för en lösning (som är ett sätt att mäta koncentrationen av hjoner+) Bestämma om en bakterier kommer att leva och reproducera eller om det tvärtom kommer att dö; och koncentrationen av ett gift kommer att avgöra om det kommer att vara dödligt eller inte.
Typer av koncentrationsenheter
Koncentrationen av en lösning är en, så det är inte korrekt att prata om typer av koncentration. Samma koncentration kan emellertid uttryckas i olika typer av koncentrationsenheter. Dessa är:
- Fysiska koncentrationsenheter
- Kemiska koncentrationsenheter
Fysiska koncentrationsenheter
Dessa kännetecknas av att uttrycka mängderna av lösta ämnen och lösningsmedlet antingen i massa eller volym. De kallas fysiska enheter, eftersom de är förknippade med massor och volymer istället för mol och motsvarande.
När vi jämför två lösningar som har samma fysiska koncentration kan vi inte se till att de har lika stora mängder atomer och molekyler. Det här är vad som skiljer dem från kemiska koncentrationsenheter.
De vanligaste fysiska koncentrationsenheterna är:
- Enkel titel (TS)
- %vikt/vikt (%p/p) eller massa/massa (%m/m)
- %Vikt/volym (%P/V) eller massa/volym (%m/V)
- % volym/volym (% v/v)
- Delar per miljon vikt/vikt (ppmp/p) eller massa/massa (ppmm/m)
- Delar per miljon vikt/volym (ppmp/v) eller massa/volym (ppmm/v)
- Delar per miljon volym/volym (ppmV/v)
Kemiska koncentrationsenheter
När det gäller kemiska enheter uttrycks mängden lösta ämnen och i vissa fall lösningsmedlet eller lösningen i termer av antalet partiklar eller mol eller ekvivalenter som finns i lösningen.
De kallas kemiska enheter, eftersom två lösningar som har samma kemiska koncentration har ekvivalenta mängder atomer, molekyler eller lösta joner per lösningsenhet, i förekommande fall.
Kan tjäna dig: Löslighetsregler: Allmänna aspekter och reglerDe vanligaste kemiska enheterna är:
- Molaritet (m)
- Molalitet (m)
- Molär fraktion (x)
- Normalitet (n)
Formel för fysiska koncentrationsenheter
Enkel titel (TS)
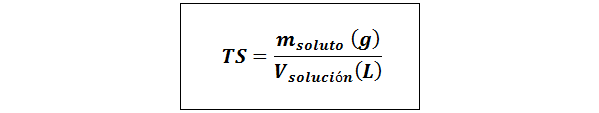
Där mlösta representerar massan av det lösta ämnet i gram och vlösning Det är lösningsvolymen i liter.
%vikt/vikt (%p/p) eller massa/massa (%m/m)
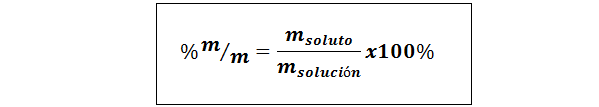
Där mlösta och Mlösning respektive representerar massan av det lösta ämnet och lösningen. Varje massenhet kan användas (g, mg, kg, etc.), så länge båda massorna uttrycks i samma enhet.
%Vikt/volym (%P/V) eller massa/volym (%m/V)
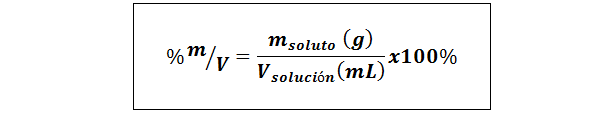
Där mlösta Det är massan av lösningen i gram och vlösning Det är lösningsvolymen, i detta fall i milliliters.
% volym/volym (% v/v)

Där vlösta och vlösning respektive representerar volymen på lösta ämnen och lösningen. I detta fall kan alla enheter användas för att uttrycka dessa volymer, så länge det är detsamma för båda.
Delar per miljon vikt/vikt (ppmp/p) eller massa/massa (ppmm/m)
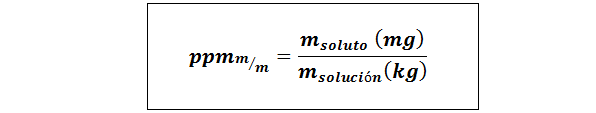
Där mlösta och Mlösning De representerar massan av det lösta ämnet och lösningen i milligram respektive kilogram.
Delar per miljon vikt/volym (ppmp/v) eller massa/volym (ppmm/v)
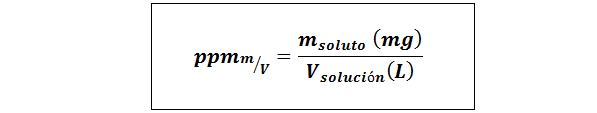
Där mlösta Det är massan av lösningen i milligram och vlösning Det är lösningsvolymen, i detta fall i liter.
Delar per miljon volym/volym (ppmV/v)
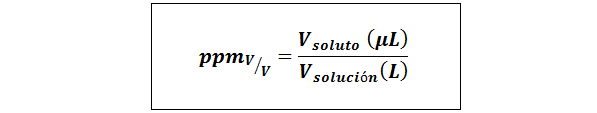
Där vlösta och vlösning De är volymen på lösta ämnen respektive lösningen hos mikroliter respektive liter.
Formler för de kemiska koncentrationsenheterna
När det gäller kemiska koncentrationsenheter uttrycks mängden av komponenterna i lösningen, i synnerhet av lösta ämnet, antingen i antal mol eller i antal ekvivalenter. Dessa mängder har det verkliga antalet partiklar (atomer, molekyler eller joner, i förekommande fall).
Dessa mängder kan inte kännas helt enkelt genom att väga eller mäta volymen av ämnen, men det är nödvändigt att känna till sammansättningen eller kemisk formel för föreningarna för att bestämma koncentrationen. Detta är det främsta skälet till att de kallas kemiska koncentrationer.
Därefter presenteras de olika formlerna för att beräkna de fyra mest använda kemiska koncentrationerna:
Molaritet (m)
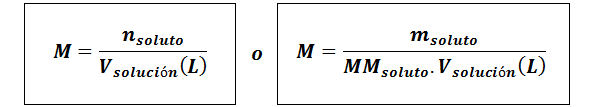
Varlösta De är molen av lösta ämnen, mlösta representerar massan av det lösta ämnet i gram, mmlösta är dess molmassa och vlösning Det är lösningsvolymen i liter.
Molalitet (m)
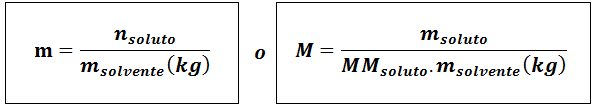
Varlösta De är molen av lösta ämnen, mlösta representerar massan av det lösta ämnet i gram, mmlösta Det är dess molmassa och mlösningsmedel Det är massan av lösningsmedlet i kilogram.
Kan tjäna dig: solvationMolär fraktion (x)
Den molära fraktionen kan beräknas för både lösta ämnen och lösningsmedlet. Den molära fraktionen av det lösta ämnet är:
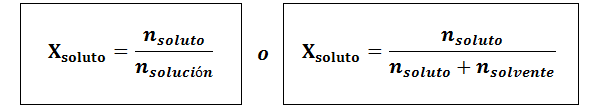
Lösningsmedlet är:
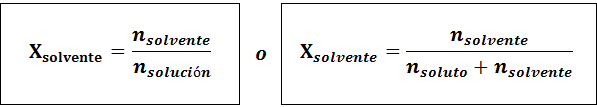
Förhållandet mellan båda molära fraktionerna är:
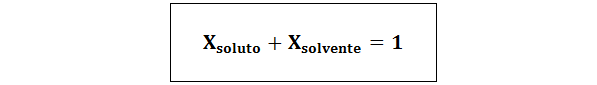
I alla fall nlösta, nlösning och nlösningsmedel är molen med lösta ämnen, lösningen respektive lösningsmedel.
Normalitet (n)
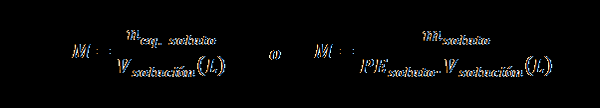
Här neq. lösta representerar antalet motsvarande lösta ämnen, mlösta representerar massan av det lösta ämnet, PElösta Det är den likvärdiga vikten av lösta ämnen och vlösning Det är lösningsvolymen i liter.
Exempel på kemisk koncentration
- Koncentrationen av salt i marint vatten är 35 g/L, vilket motsvarar en molaritet av 0,60 mol/l.
- Den genomsnittliga blodsockerkoncentrationen är mellan 82 mg/dL och 110 mg/dL. Dessa koncentrationer motsvarar en enkel titel vid 0,82 g/l och 1,10 g/l och i molaritet vid 4.4.10-3 mol/l och 6.1.10-3 mol/L respektive.
- Luften kan betraktas som en gasformig lösning bildad huvudsakligen av kväve och syre, varvid lösningsmedlet är kväve, eftersom det är i större proportion. Denna gaslösning innehåller en 0,22 syre- och kvävefraktion på cirka 0,78.
- Stål är en legering mellan järn och kol. Även om de inte är strikt lösningar, är dessa homogena fasta blandningar som vanligtvis innehåller en kolkoncentration i storleksordningen 0,03% och 1 075% i massa.
- Trots dess förödande effekter för miljön och för människors hälsa är koncentrationerna av många föroreningar vanligtvis betydligt låga. Ett exempel är den maximala koncentrationen av arsenik giftig metall i vatten. Världshälsoorganisationen (WHO) konstaterade att dricksvatten inte skulle innehålla en arsenikoncentration större än 10ppb m/v (delar per miljard eller nanogram per liter). Denna koncentration motsvarar 0.010 ppm m/v.
Referenser
- BBC (s. F.). Koncentration av lösningar - Beräkningar i kemi - AQA - GCSE Chemistry (Single Science) Review - AQA. BBC taget.co.Storbritannien.
- Här är vad koncentrationen betyder i kemi (2020). Borttagen från tankco.com.
- Librettexts (2022). 4.5: Koncentration av lösningar. Hämtad från kem.Librettexts.org.
- Mandal, a., VD. (2021). Normala blodsockersvärden. Hämtad från nyhetsmedicinska.netto.
- Kemikalier.Net (s. F.). Kemiska koncentrationer. Hämtad från kemiker.netto.

