Kärnelektronisk konfigurationskonstruktion, exempel
- 4671
- 1213
- Johan Gustafsson
De Kärnelektronisk konfiguration eller kompakt är att vars kvantnotationer om antalet elektroner och deras energiundervelar förkortas av symbolerna för ädla gaser i fyrkantiga parenteser. Det är mycket användbart när du skriver elektroniska konfigurationer för ett visst element, eftersom det är enkelt och snabbt.
Ordet "kärna" hänvisar vanligtvis till de elektroniska inre skikten i en atom; Det vill säga de där deras elektroner inte kommer från Valencia och därför inte deltar i den kemiska bindningen, även om de definierar elementets egenskaper. Metaforiskt sett skulle kärnan vara lökens inre, med dess lager bestående av en serie växande orbitaler i energi.
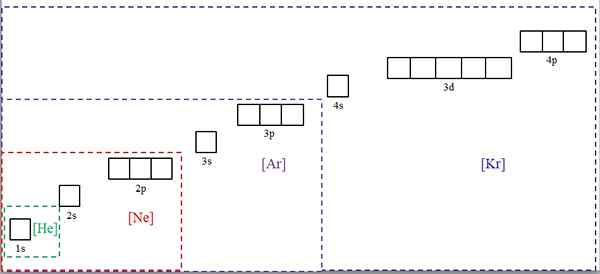
 Elektroniska konfigurationer förkortade med symbolerna för ädla gaser. Källa: Gabriel Bolívar.
Elektroniska konfigurationer förkortade med symbolerna för ädla gaser. Källa: Gabriel Bolívar. Den överlägsna bilden visar kemiska symboler för fyra av de ädla gaserna i fyrkantiga konsoler och med olika färger: [He] (grön), [NE] (röd), [ar] (lila) och [KR] (blå) (blå).
Var och en av dess prickade ramar innehåller lådor som representerar orbitalerna. Ju större, desto större är antalet elektroner som innehåller; Vilket i sin tur kommer att innebära att de elektroniska konfigurationerna av fler element kan förenklas med dessa symboler. Detta sparar tid och energi genom att skriva alla notationer.
[TOC]
Konstruktionsorder
Innan du använder kärnkraftskonfigurationer är det bekvämt att granska rätt ordning för att bygga eller skriva dessa konfigurationer. Detta styrs enligt diagonalregeln eller Moeller -diagrammet (kallas i vissa delar av regnet). Med detta diagram till hands kvarstår kvantnotationer på följande sätt:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Kan tjäna dig: grundläggande salter: formel, egenskaper, nomenklatur, exempelDenna rad med kvantnotationer ser utmattad ut; Och det skulle vara ännu mer om du var tvungen att skriva det hela tiden för att bli representerad den elektroniska konfigurationen för alla element som hittades i perioden 5 och framåt. Observera att raden är tom för elektroner; Det finns inga siffror vid högre rättigheter (1s22s22 p6...).
Det bör komma ihåg att orbitalerna s kan "vara värd" två elektroner (NS2). Orbitalerna p Det finns totalt tre (titta på de tre rutorna ovan), så att de kan vara värd för sex elektroner (NP6). Och slutligen orbitalerna d Det finns fem och F sju, med totalt tio (ND10) och fjorton (NF14) elektroner, respektive.
Elektronisk konfigurationsförkortning
Som sagt, den främre raden med kvantnotationer är fylld med elektroner:
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Hur många elektroner är totalt? 118. Och vilket element motsvarar en så enorm mängd elektroner i dess atom? Till ädla oganisen, OG.
Anta att det finns ett element med ett kvantnummer Z lika med 119. Sedan skulle dess elektroniska konfiguration Valencia vara 8s1; Men vad skulle vara dess kompletta elektroniska konfiguration?
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6 8S1
Och vad skulle vara din kärnelektroniska konfiguration, den kompakta? Detta:
[Og] 8s1
Notera den uppenbara förenklingen eller förkortningen. I symbolen [og] räknas alla de 118 elektronerna som skrivs ovan, så detta osäkra element har 119 elektroner, varav endast en kommer från Valencia (det skulle vara beläget under Francio i det periodiska tabellen).
Kan tjäna dig: vad är en mättad lösning? (Med exempel)Exempel
Allmän
Anta nu att du vill utföra förkortningen gradvis:
[Han] 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Observera att 1s2 Det ersattes av [han]. Nästa ädla gas är neon, som har 10 elektroner. Genom att veta detta fortsätter förkortningen:
[NE] 3S2 3p6 4S2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Följ sedan argon, med 18 elektroner:
[Ar] 4s2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Eftersom nästa ädla gas är Kripton är ytterligare 36 elektroner avancerad:
[KR] 5S2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Xenon har 54 elektroner, och därför flyttar vi förkortningen till 5p orbital:
[Xe] 6s2 4f14 5 D10 6p6 7s2 5F14 6d10 7p6
Vid denna punkt förkortas alltid den elektroniska konfigurationen till NP -omloppet; Det vill säga ädla gaser har dessa orbitaler fulla av elektroner. Och slutligen följ radonen, med 86 elektroner, så vi förkortar till 6p orbital:
[Rn] 7s2 5F14 6d10 7p6
Syre
Syre har åtta elektroner, som är dess kompletta elektroniska konfiguration:
1s22s22 p4
Den enda förkortningen vi kan använda är [han] av 1s2. Således är dess kärnelektroniska konfiguration:
[Han] 2s22 p4
Kalium
Kalium har nitton elektroner, som är dess kompletta elektroniska konfiguration:
Kan tjäna dig: var kommer plast ifrån? Historia och typer1s2 2s2 2 p6 3s2 3p6 4S1
Observera att vi kan använda symbolen [han] för att förkorta den konfigurationen; liksom [ne] och [ar]. Det senare är det som används eftersom argon är den ädla gasen som föregår den närmast kalium. Därför kvarstår dess kärnelektroniska konfiguration:
[Ar] 4s1
Indisk
Indianen har fyrtio -nine elektroner, som är dess kompletta elektroniska konfiguration:
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d10 5 p1
Eftersom Kripton är den närmaste ädla gasen som föregår indianerna, används [KR] -symbolen för förkortning, och dess kärnelektroniska konfiguration har:
[KR] 5S2 4d10 5 p1
Även om 4D -orbitaler inte formellt tillhör den indiska kärnan, ingriper deras elektroner inte (åtminstone under normala förhållanden) i sin metallbindning, utan de från 5s och 5p orbitaler.
Volfram
Tungsten (eller Wolframio) har 74 elektroner och dess kompletta elektroniska konfiguration är:
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d10 5 p6 6s2 4f14 5 D4
Återigen letar vi efter den närmaste ädla gasen. I hans fall motsvarar det Xenón, som har sina 5p orbitaler komplett. Således ersätter vi raden med kvantnotationer med symbolen [XE], och vi kommer äntligen att ha sin kärnelektroniska konfiguration:
[Xe] 6s2 4f14 5 D4
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Pathagers. (2016). Elektronkonfigurationsdiagram. Återhämtat sig från: ChemistryApp.org
- Helmestine, Anne Marie, PH.D. (5 december 2018). Noble Gas Core Definition. Återhämtat sig från: tankco.com/
- Wikipedia. (2019). Elektronisk konfiguration. Återhämtad från: är.Wikipedia.org
- « Uranium Disco -historia och sångare som har vunnit det
- Tuskegee Experimenthistoria, motiv och kritik »

