Galvaniska korrosionsmekanismer, exempel, skydd

- 4904
- 1297
- Erik Eriksson
De Galvanisk eller elektrokemisk korrosion Det är en process genom vilken en metall eller legering bryts ned mer svindel jämfört med dess konventionella oxidation. Det kan sägas att det är en accelererad oxidation och till och med avsiktligt leds; Som i batterier eller batterier.
Detta sker under en serie förhållanden. Först måste det finnas en aktiv metall, kallad anod. Även, och för det andra måste det finnas lite reaktiv ädla metall som kallas katod. De tredje och fjärde förhållandena är närvaron av ett medium där elektroner sprids, såsom vatten och joniska eller elektrolytarter.
 Oxiderad järnkrona. Källa: Pixnio.
Oxiderad järnkrona. Källa: Pixnio. Galvanisk korrosion kan observeras särskilt i marina miljöer eller på stränderna. Luftströmmar lyfter vattenånga massor, som i sin tur drar några joner; Den senare hamnar med att hålla sig till ett tunt lager vatten eller droppar som vilar på metallytan.
Dessa förhållanden för luftfuktighet och salthalt gynnar metallkorrosion. Det vill säga en järnkrona som den i den överlägsna bilden kommer att oxidera snabbare om den utsätts för havets närliggande hav.
Den lätthet som en metall måste oxidera jämfört med en annan kan mätas kvantitativt genom dess reduktionspotentialer; I kemiböckerna finns det i överflödtabeller med dessa potentialer och. Ju mer negativ, desto större är din lutning att oxidera.
Om denna metall är i närvaro av en annan med en mycket positiv reduktionspotential, och har därför en stor ΔE, kommer oxidationen av den reaktiva metallen att vara mer aggressiv. Andra faktorer, såsom pH, jonisk kraft, luftfuktighet, närvaron av syre och förhållandet mellan metallområdena som oxideras och den som reduceras är också viktigt.
[TOC]
Mekanismer
Begrepp och reaktioner
Innan man tar upp mekanismerna bakom galvanisk korrosion måste vissa koncept klargöras.
I en reaktion Rédox förlorar en art elektroner (oxiderade) medan en annan vinner dem (den reduceras). Elektroden på vilken oxidation inträffar kallas anod; Och på vilken reduktionen inträffar används katoden (på engelska den nemoniska regeln vanligtvis Redkatt att komma ihåg).
Således för en elektrod (en bit, skruv, etc.) av en metall m, om detta oxideras sägs det att det är anoden:
M => mn+ + inte-
Antalet frisatta elektroner kommer att vara lika med storleken på den positiva belastningen av katjon Mn+ resulterande.
Sedan tar en annan elektrod eller metall (båda metallerna i kontakt på något sätt), de frigjorda elektronerna; Men detta lider inte av en kemisk reaktion om de får elektroner, eftersom det bara skulle vara att utföra dem (elektrisk ström).
Därför måste det finnas en annan art i lösning som dessa elektroner formellt kan acceptera; Så lätt att minska metalljoner, till exempel:
Kan tjäna dig: inhomogent systemRn+ + inte- => R
Det vill säga, ett lager av metall R skulle bildas och elektroden skulle bli tyngre; Medan metallen M skulle förlora mässan eftersom deras atomer upplöses.
Depolarisatorer
Och om det inte fanns några metallkatjoner som kunde minskas tillräckligt? I så fall kommer andra arter som finns i mitten att ta elektroner: depolarizadores. Dessa är intimt relaterade till pH: o2, H+, Åh- och h2ANTINGEN.
Syre och vatten får elektroner i en reaktion uttryckt av följande kemiska ekvation:
ANTINGEN2 + 2h2O + 4e- => 4OH-
Medan joner h+ De förvandlas till H2:
2h+ + 2e- => H2
Det vill säga oh arter- och h2 De är vanliga produkter av galvaniska eller elektrokemiska korrosioner.
Även om Metal R inte deltar i någon reaktion, är faktumet att vara mer ädla som M främjar dess oxidation; Och följaktligen kommer det att finnas en större produktion av OH -joner- o vätgas. Eftersom det trots allt är skillnaden mellan reduktionspotentialer, ΔE, en av de viktigaste motorerna för dessa processer.
Järnkorros
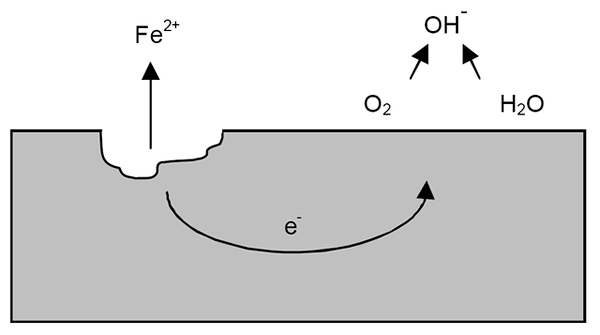 Korrosionsmekanism för järn. Källa: Wikipedia.
Korrosionsmekanism för järn. Källa: Wikipedia. Efter de tidigare förtydligandena kan exemplet med järnkorrosion (överlägsen bild) tas upp. Anta att det finns ett tunt vattenskikt där syre upplöses. Utan närvaro av andra metaller kommer det att vara depolarizadores som kommer att markera reaktionsriktlinjerna.
Således kommer järn att förlora vissa atomer på ytan för att lösa upp i vatten som troskatjoner2+:
Fe => tro2+ + 2e-
De två elektronerna kommer att resa järnstycket för att vara en bra elektricitetsledare. Så att det är känt var oxidation eller anodisk plats började; Men inte där reduktionen eller platsen för den katodiska platsen kommer att fortsätta. Den katodiska platsen kan vara var som helst; Och ju högre dess möjliga område är värre att vara korrosion av metallen.
Anta att elektroner når en punkt som visas i den övre bilden. Där lider både syre och vatten den redan beskrivna reaktionen, genom vilken OH släpps-. Dessa anjoner åh- De kan reagera med tro2+ Att bilda tro (OH)2, som fälls ut och lider efterföljande oxidationer som äntligen förvandlar den till rost.
Under tiden spricker den anodiska platsen mer och mer.
Exempel
I det dagliga livet är exemplen på galvaniska korrosioner många. Vi behöver inte hänvisa till järnkronan: någon artefakt gjord av metaller kan drabbas av samma process i närvaro av våta och saltlösningsmiljöer.
Kan tjäna dig: fosfatgruppFörutom stranden kan vintern också bidra med de ideala förhållandena för korrosion; Till exempel när du kastar salter till vägsnön för att förhindra att bilar åker skridskor.
Ur fysisk synvinkel kan det i de svetsade fackföreningarna behålla fukt, vara aktiva korrosionsplatser. Detta beror på att båda metallerna beter sig som två elektroder, och de mest reaktiva kommer att förlora sina elektroner.
Om Oh Ion -produktion- Det är betydande, du kan till och med köra färgen på bilen eller artefakten i fråga.
Anodiska index
Man kan bygga sina egna exempel på galvaniska korrosioner med hjälp av reduktionspotentialtabellerna. Emellertid kommer den anodiska indextabellen (förenklad av sig själv) att väljas för att illustrera denna punkt.
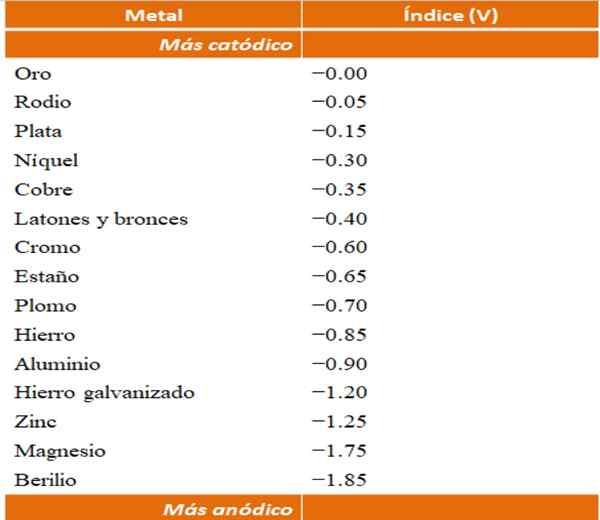 Anodiska index för olika metaller eller legeringar. Källa: Wikipedia.
Anodiska index för olika metaller eller legeringar. Källa: Wikipedia. Anta till exempel att vi vill bygga en elektrokemisk cell. Metallerna som är den övre delen av tabellen Anodiska index är mer katod; det vill säga de är lätt att reduceras och det kommer därför att vara svårt att ha dem i lösning. Medan metaller som är längst ner är mer anodiska eller reagens och lätt körs.
Om vi väljer guld och beryllium, kunde båda metallerna inte vara tillsammans på länge, eftersom beryllium skulle oxidera med extrem snabb.
Och om vi tvärtom har en agjonlösning+ Och vi fördjupar en aluminiumstång i den, den kommer att lösa upp samtidigt som utfällning av metallsilverpartiklar. Om denna stapel ansluter till en grafitelektrod skulle elektroner resa till den för att elektrokemiskt deponera silver som en silverfilm.
Och om i stället för aluminiumstången är ur koppar, skulle lösningen bli blåaktig av närvaron av jonerna Cu2+ i vatten.
Skydd mot elektrokemisk korrosion
Offerbeläggningar
Anta att det är avsett att skydda en lamina av korrosion i närvaro av andra metaller. Det enklaste alternativet skulle vara att lägga till magnesium, som skulle täcka zinken så att elektronerna, när de oxideras, minskar elektronerna från magnesium Zn -katjonerna2+ tillbaka.
Men Mgos film om zink förr snarare än senare skulle hamna i sprickor, vilket ger den aktuella webbplatsen med hög densitet; det vill säga zinkkorrosion skulle accelerera skarpt vid dessa punkter.
Denna teknik för skydd mot elektrokemisk korrosion kallas användning av offerbeläggning. Det mest kända är zink, som används i den berömda tekniken som heter Galvanization. I dem täcks metall M, särskilt järn, zink (tro/zn).
Kan tjäna dig: fenolftalin (C20H14O4)Återigen oxiderar zink och dess oxid tjänar till att täcka järn och överföra elektroner som minskar tron2+ som kan bildas.
Ädla beläggningar
Anta igen att du vill skydda samma zinkark, men nu kommer krom att användas istället för magnesium. Krom är mer ädel (mer katodisk, se tabellen för anodiska index) än zink, och det är därför det fungerar som en ädel beläggning.
Problemet med denna typ av beläggning är att när den när den spricker kommer den att främja och ytterligare påskynda oxidationen av metallen nedan; I detta fall är zink korroderad ännu mer än att vara täckt med magnesium.
Och slutligen finns det andra beläggningar som består av målningar, plast, antioxidanter, fetter, hartser etc.
Barns experiment
Järnplatta i kopparsalter
Ett enkelt experiment kan utformas från samma tabell med anodiska index. Lös upp ett rimligt belopp (mindre än 10 gram) av CUSO4· 5h2Eller i vatten uppmanas ett barn att fördjupa sig på en polerad järnplatta. Ett foto tas och processen får utvecklas i ett par veckor.
Upplösningen är initialt blåaktig, men den kommer att börja förlora färg medan järnplattan får en kopparfärg. Detta beror på att koppar är ädla än järn, och därför är dess katjoner cu2+ De kommer att reduceras till metallisk koppar från de joner som tilldelats genom oxidation av järn:
Fe => tro2+ + 2e-
Cu2+ + 2e- => Cu
Rengöring av silveroxid
Silverföremål svartar över tiden, särskilt om de är i kontakt med en källa till svavelföreningar. Dess oxid kan avlägsnas om föremålet är nedsänkt i ett vattenbadkar med natriumbikarbonat och aluminiumfolie. Bikarbonat tillhandahåller elektrolyter som underlättar transport av elektroner mellan objektet och aluminium.
Som ett resultat kan barnet uppskatta att objektet förlorar sina svarta fläckar och kommer att lysa med sin karakteristiska silverfärg; Medan aluminiumfolien kommer att löpa tills den försvinner.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2019). Galvanisk korrosion. Hämtad från: i.Wikipedia.org
- Stephen Lower. (16 juni 2019). Elektokemisk korrosion. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Det öppna universitetet. (2018). 2.4 Korrosionsprocess: Galvanisk korrosion. Återhämtad från: öppen.Edu
- Kundteknisk serviceborste Wellman Inc. (s.F.). En guide till galvanisk korrosion. Borsta wellman konstruerade material.
- Giorgio Carboni. (1998). Experiment i elektokemi. Hämtad från: fensci.com
- « Sophistiska relativism ursprung, egenskaper, exempel
- Cykliska kolvätenstruktur, egenskaper, exempel »

