Svaveldioxid (SO2) struktur, egenskaper, användningar, risker

- 892
- 25
- Johan Eriksson
han svaveldioxid Det är en gasformig oorganisk förening bildad av svavel (er) och syre (O), som är dess kemiska formel så2. Det är en färglös gas med irriterande och kvävande lukt. Dessutom är det vattenlösliga bildande syralösningar. Vulkaner utvisar honom mot atmosfären under utbrott.
Det är en del av den biologiska och geokemiska svavelcykeln, men produceras i stora mängder av vissa mänskliga aktiviteter såsom raffinering av olja och brinnande fossila bränslen (kol eller diesel till exempel).
 Svaveldioxid så2 utfärdas av vulkaner under utbrott. Brocken Inaglory [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Svaveldioxid så2 utfärdas av vulkaner under utbrott. Brocken Inaglory [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Så2 Det är ett reducerande medel som gör att pappersmassa kan förbli vit efter penningtvätt med andra föreningar. Det tjänar också till att eliminera klorrester i vattnet som har behandlats med denna kemist.
Det används för att hålla vissa typer av mat, för att desinficera behållare där jäsningen av druvsaft uppstår för att producera vin eller korn för att göra öl.
Det används också som en fungicid inom jordbruket för att få svavelsyra, som lösningsmedel och som mellanhand i kemiska reaktioner.
Så2 Närvarande i atmosfären är skadligt för många växter, i vattnet påverkar fisken och är också en av de som är ansvariga för "surt regn" som korroderar materialen som skapats av människan.
[TOC]
Strukturera
Svaveldioxidmolekylen är symmetrisk och bildar en vinkel. Vinkeln beror på att så2 Den har ett par ensamma elektroner, det vill säga elektroner som bildar koppling till alla atom men är gratis.
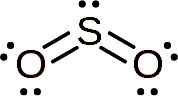 Lewis struktur av svaveldioxid där dess vinkelform och paret med fria elektroner observeras. Whittlemario [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Lewis struktur av svaveldioxid där dess vinkelform och paret med fria elektroner observeras. Whittlemario [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Nomenklatur
- Svaveldioxid
- Svaveldydrid
- Svaveloxid.
Egenskaper
Fysiskt tillstånd
Färglös gas.
Molekylvikt
64,07 g/mol
Smältpunkt
-75,5 ºC
Kokpunkt
-10.05 ºC
Densitet
Gas: 2,26 till 0 ° C (relativt luften, det vill säga lufttäthet = 1). Detta betyder att det är tyngre än luften.
Vätska: 1,4 A -10 ° C (relativt vatten, det vill säga vattentäthet = 1).
Löslighet
Vattenlösligt: 17,7% vid 0 ° C; 11,9% vid 15 ° C; 8,5% vid 25 ° C; 6,4% vid 35 ° C.
Löslig i etanol, dietyleter, aceton och kloroform. Det är mindre lösligt i icke -polära lösningsmedel.
pH
De vattenhaltiga SOS -lösningarna2 De är sura.
Kemiska egenskaper
Så2 Det är ett kraftfullt reducerande och oxiderande medel. I närvaro av luft och en katalysator oxiderar så3.
Sw2 + ANTINGEN2 → så3
Par av ensamma elektroner gör att det ibland beter sig som en bas av Lewis, med andra ord kan det reagera med föreningar där det finns en atom som saknas elektroner.
Det kan tjäna dig: Järn arkivering: egenskaper, hur de görs, toxicitet, användningarOm så är fallet2 Det är i form av gas och torr att attackerar inte järn, stål, kopparnicklegeringar eller nickel-krom-hydrro. Men om det är i ett flytande eller fuktigt tillstånd, producerar det korrosion till dessa metaller.
Så2 Vätska med 0,2% vatten eller mer producerar starkt järn-, mässing- och kopparkorrosion. Det är frätande för aluminium.
När det är flytande kan du också attackera vissa plast, gummi och beläggningar.
Vattenhaltiga sos av så2
Så2 Det är mycket lösligt i vatten. Det ansågs länge att i vatten svavelsyra form h2Sw3, Men förekomsten av denna syra har inte visats.
I så lösningar2 I vatten inträffar följande balanser:
Sw2 + H2Eller ⇔ så2.H2ANTINGEN
Sw2.H2Eller ⇔ hso3- + H3ANTINGEN+
Hso3- + H2Eller ⇔ så32- + H3ANTINGEN+
Där hso3- Det är bisulfitjonen och den så32- Det är sulfitjonen. Sulfitjonen så32- Det förekommer främst när en alkali läggs till i SO -lösningen2.
De vattenhaltiga SOS -lösningarna2 De har minskande egenskaper, särskilt om de är alkaliska.
Andra egenskaper
- Det är extremt stabilt jämfört med värme, även upp till 2000 ° C.
- Det är inte brandfarligt.
Erhållande
Så2 Det erhålls genom svavelförbränning i luften, även om små mängder så formar också bildas3.
S + o2 → så2
Det kan också produceras genom uppvärmning i luften hos olika sulfider, brinnande pyritmineraler och mineraler som innehåller sulfider, bland andra.
I fallet med järnpyriten, när oxiderad järnoxiden (iii) och SO erhålls2:
4 Fes2 + 11 o2 → 2 tro2ANTINGEN3 + 8 Så2↑
Närvaro
Så2 Det släpps till atmosfären genom aktiviteten hos vulkaner (9%) men härstammar också från andra naturliga aktiviteter (15%) och av mänskliga handlingar (76%).
Explosiva vulkanutbrott orsakar betydande årliga fluktuationer eller variationer2 i atmosfären. Det uppskattas att 25% av SO2 av vulkaner tvättas av regn innan de når stratosfären.
Naturliga källor är de vanligaste och beror på den biologiska svavelcykeln.
I stads- och industriområden dominerar mänskliga källor. Den huvudsakliga mänskliga aktiviteten som producerar den är förbränning av fossila bränslen, såsom kol, bensin och diesel. Andra mänskliga källor är oljeraffinaderier, kemiska växter och gasproduktion.
 Mänskliga aktiviteter som kolförbränning för el är källa till föroreningar med SO2. Adrem68 [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Mänskliga aktiviteter som kolförbränning för el är källa till föroreningar med SO2. Adrem68 [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Hos däggdjur genereras det på ett endogent sätt, det vill säga inom kroppen av djur och människor på grund av metabolismen hos aminosyror som innehåller svavel, särskilt L-cystein.
Kan tjäna dig: flytande element: vad är och exempelAnsökningar
Vid produktion av svavelsyra
En av de viktigaste tillämpningarna av SO2 Det är för att få svavelsyra h2Sw4.
2 så2 + 2 h2Eller + o2 → 2 h2Sw4
I den bearbetade livsmedelsindustrin
Svaveldioxid används som matkonserveringsmedel och stabilisator, som ett medel för fuktkontroll och som en modifierare av smak och struktur för vissa ätliga produkter.
Det används också för att desinficera utrustning som kommer i kontakt med matvaror, jäsningsutrustning, såsom bryggerier och viktiga, matbehållare etc.
Det gör det möjligt att bevara frukt och grönsaker, ökar livslängden på stormarknadshyllan, förhindrar förlust av färg och smak och hjälp vid kvarhållning av C -vitamin (askorbinsyra) och karoten (föregångare till A -vitamin).
 Torkad frukter förblir fria från svampar och bakterier tack vare SO2. Författare: Isabel Ródenas. Källa: Pixabay.com
Torkad frukter förblir fria från svampar och bakterier tack vare SO2. Författare: Isabel Ródenas. Källa: Pixabay.com Det tjänar till att hålla vin, eftersom det förstör bakterier, svampar och oönskade jäst. Det används också för att sterilisera och förhindra bildning av nitrosaminer i öl.
 Kornfermenteringsutrustningen för att få öl steriliseras med så2. Författare: Ceridebbie. Källa: Pixabay.
Kornfermenteringsutrustningen för att få öl steriliseras med så2. Författare: Ceridebbie. Källa: Pixabay. Det används också för att blötlägga majskorn, för att bleka betesocker och som antimikrobiellt i tillverkningen av majs sirap med hög fruktos.
Som lösningsmedel och reaktivt
Det har använts allmänt som ett icke -vattenhaltigt lösningsmedel. Även om det inte är ett joniserande lösningsmedel är det användbart som ett lösningsmedel utan protoner för vissa analytiska tillämpningar och kemiska reaktioner.
Det används som ett lösningsmedel och reagens i organisk, mellanhand vid produktion av andra föreningar såsom klordioxid, acetylklorid och i oljesulfonering.
Som ett reducerande agent
Det används som ett reducerande medel trots att det inte är så starkt, och i alkalisk lösning bildas sulfitjonen som är ett mer energiskt reducerande medel.
I flera applikationer
Så2 Det används också:
- Inom jordbruk som fungicid och konserveringsmedel för druv efter skörd.
- Att tillverka hydrosulfit.
- Till blekmedel trä och pappersmassa, eftersom det tillåter stabilisering av massan efter tvätt med väteperoxid h2ANTINGEN2; Så2 handlingar genom att förstöra h2ANTINGEN2 rest och därmed behålla massans ljusstyrka, som h2ANTINGEN2 kan orsaka en ljusstyrka reversering.
- För att bleka textilfibrer och korgartiklar.
- För att behandla vatten eliminerar det det återstående klor som återstår efter klorering av dricksvatten, avloppsvatten eller industriellt vatten.
- Vid raffinering av mineraler och metaller, som ett järnreducerande medel under mineralbearbetning.
- Vid raffinering av olja för att fånga syre och fördröja korrosion och som extraktionslösningsmedel.
Kan tjäna dig: balansering av kemiska ekvationer- Som antioxidant.
- Som alkalisneutralisator i glasstillverkning.
- I litiumbatterier som ett oxiderande medel.
Effekter av så2 endogen
Vissa studier har visat att SO2 Endogen eller producerad av själva organismen har en gynnsam effekt på hjärt -kärlsystemet, inklusive regleringen av hjärtans funktion och avkoppling av blodkärl.
När den förekommer i organismen2 Det blir dess derivat bisulfite hso3- och sulfit så32-, som utövar en vasorelajadoreffekt av artärerna.
Så2 Endogen minskar hypertoni, förhindrar utvecklingen av åderförkalkning och skyddar hjärtat av myokardskador. Det utövar också en antioxidantverkan, hämmar inflammation och apoptos (programmerad celldöd).
Av dessa skäl tros det att det kan vara en möjlig ny terapi för hjärt -kärlsjukdomar.
 Hjärtat kan dra nytta av SO2 producerad av organismen. Författare: OpenClipart-Vectors. Källa: Pixabay.
Hjärtat kan dra nytta av SO2 producerad av organismen. Författare: OpenClipart-Vectors. Källa: Pixabay. Risker
- Exponering för så2 Gaster kan leda till brännskador i ögon, hud, hals och slemhinnor, skador på bronki och lungor.
- Vissa studier rapporterar att det har en potentiell risk för skador på det genetiska materialet i däggdjur och mänskliga celler.
- Det är frätande. Det är inte brandfarligt.
Ekotoxicitet
Svaveldioxid är den vanligaste förorenande gasen i atmosfären, särskilt i stads- och industriområden.
Dess närvaro i atmosfären bidrar till det så kallade "syra regn" som är skadligt för vattenlevande organismer, fisk, landvegetation och korrosion till material som människan har gjort.
 Monument skadat av surt regn. Nino Barbieri [CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons.
Monument skadat av surt regn. Nino Barbieri [CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons. Så2 Det är giftigt för fisk. Gröna växter är extremt känsliga för så2 atmosfärisk. Alfalfa, bomull, korn och vete skadas med låga miljönivåer, medan potatis, lök och majs är mycket mer motståndskraftiga.
Effekter av intag av det med mat
Även om det är ofarligt för friska människor, när de används i de koncentrationer som rekommenderas av auktoriserade hälsobyråer, så2 kan inducera astma till känsliga människor som äter det med mat.
 Känsliga människor kan drabbas av astma genom att äta mat med små mängder så2. Suraj på Malayalam Wikipedia [public domain]. Källa: Wikimedia Commons.
Känsliga människor kan drabbas av astma genom att äta mat med små mängder så2. Suraj på Malayalam Wikipedia [public domain]. Källa: Wikimedia Commons. Maten som vanligtvis innehåller den är torkad frukt, konstgjorda läsk och alkoholhaltiga drycker.
Referenser
- ELLER.S. National Library of Medicine. (2019). Dioxidsvavel. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Huang och. et al. (2016). Endogen svaveldioxid: En ny mjukt av Gasotransmitter -familjen i hjärt -kärlsystemet. Oxidmed cell longev. 2016; 2016: 8961951. NCBI återhämtade sig.Nlm.Nih.Gov.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Windholz, m. et al. (redaktörer) (1983). Merck -indexet. En enyklopedi av kemikalier, droger och biologiska. Tionde upplagan. Merck & Co., Inkl.
- Bröd, x. (2011). Oxider Svavel: Källor, exponeringar och hälsoeffekter. Hälsoeffekter av svaveloxider. I Encyclopedia of Environmental Health. Återhämtat sig från Scientedirect.com.
- Tricker, R. och tricker, s. (1999). Föroreningar och föroreningar. Svaveldioxid. I miljöbehov för elektromekanisk och elektronisk utrustning. Återhämtat sig från Scientedirect.com.
- Bleam, W. (2017). Syrabasskemi. Oxider svavel. I jord och miljökemi (andra upplagan). Återhämtat sig från Scientedirect.com.
- Freedman, f.J. (1980). Svaveldioxid i livsmedel och drycker: dess användning ett konserveringsmedel och dess effekt på astma. Br J Dis Chest. 1980; 14 (2): 128-34. NCBI återhämtade sig.Nlm.Nih.Gov.
- Craig, K. (2018). En översyn av kemi, bekämpningsmedel och miljömässigt öde för svaveldioxid, som används i Kalifornien. I recensioner av miljöföroreningar och toxikologi. Volym 246. Länk återhämtat sig.Kandare.com.
- « Silicon Nitruro (SI3N4) Struktur, egenskaper, erhållning, användning
- Aluminiumpolyloridstruktur, egenskaper, erhållning, användning »

