Differentiell elektron

- 3814
- 548
- Erik Eriksson
han differentiell elektron o Differentiator är den sista elektronen placerad i sekvensen för den elektroniska konfigurationen av en atom. Vad heter du? För att besvara denna fråga är det nödvändigt att känna till en atoms grundstruktur: dess kärna, tomrummet och elektronerna.
Kärnan är ett tätt och kompakt aggregat av positiva partiklar som kallas protoner och neutrala partiklar som kallas neutroner. Protonerna definierar atomantalet Z och, tillsammans med neutronerna, utgör atommassan. En atom kan emellertid inte bara bära positiva laddningar; Därför går elektronerna runt kärnan för att neutralisera den.
 Grundläggande atomstruktur: Huvudsakliga subatomära partiklar
Grundläggande atomstruktur: Huvudsakliga subatomära partiklar För varje proton som lägger till kärnan införlivas således en ny elektron i sina orbitaler för att motverka den växande positiva laddningen. På detta sätt är den nya tillsatta elektronen, den differentiella elektronen, nära besläktad med atomnumret Z.
Differentialelektronen finns i det yttersta elektroniska lagret: Valencia -lagret. Därför, ju längre kärnan är, desto större är energin förknippad med den. Denna energi ansvarar för dess deltagande, liksom för resten av Valencia -elektronerna, i de kemiska reaktionerna som är karakteristiska för elementen.
[TOC]
Kvantantal
Förutom resten av elektronerna kan den differentiella elektronen identifieras med dess fyra kvantantal. Men vad är kvantantalet? De är "n", "l", "m" och "s".
Kvantnumret "n" anger storleken på atom- och energinivåerna (k, l, m, n eller, p, q). "L" är det sekundära eller acemutala kvantantalet, vilket indikerar formen på atomorbitalerna, och tar värden 0, 1, 2 och 3 för orbitalerna "S", "P", "D" och "F ", respektive.
Det kan tjäna dig: Aforerad kolv: Egenskaper, vad är det för, typer, användningar"M" är det magnetiska kvantantalet och indikerar den rumsliga orienteringen av orbitalerna under ett magnetfält. Således 0 för omloppet "S"; -1, 0, +1, för orbital "p"; -2, -1, 0, +1, +2, för orbital “D”; och -3, -2, -1, 0, +1, +2, +3, för orbital “f”. Slutligen kvantantalet spin “S” (+1/2 för ↑ och -1/2 för ↓).
Därför har en differentiell elektron associerat de tidigare kvantnummer ("n", "l", "m", "s"). Eftersom det motverkar den nya positiva belastningen som genereras av den ytterligare protonen, ger den också atomantalet Z för elementet.
Hur man vet den differentiella elektronen?
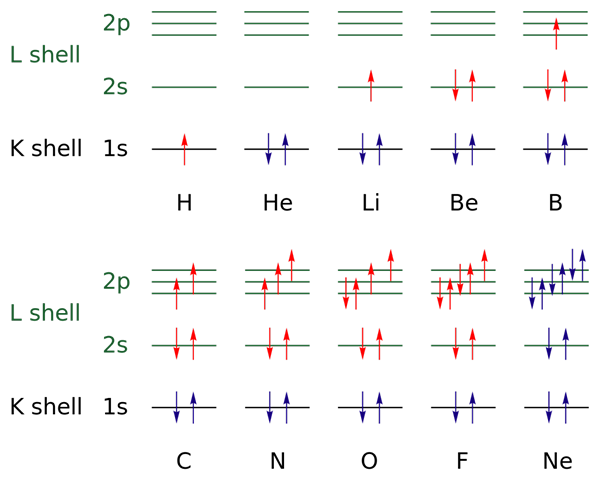
I den övre bilden representeras elektroniska konfigurationer för elementen från väte till neongas (H → NE).
I detta indikeras elektronerna i de öppna skikten med färgen röd, medan de i de stängda skikten indikeras med färgen blå. Skikten hänvisar till kvantantalet "n", det första av de fyra.
På detta sätt lägger Valencia -konfigurationen av H (↑ av rött) till en annan elektron med motsatt orientering för att bli den för HE (↓ ↑, båda blå för nu är nivån 1 stängd). Denna tillagda elektron är då den differentiella elektronen.
Således kan det observeras hur den differentiella elektronen lägger till valensskiktet (röda pilar) från elementen och skiljer dem från varandra. Elektronerna fyller orbitalerna med respekt för diskbänk och Paulings uteslutningsprincip (perfekt observerad från B till NE).
Och hur är det med kvantantal? Dessa definierar varje pil - det vill säga varje elektron - och dess värden kan bekräftas med den elektroniska konfigurationen för att veta om de i den differentiella elektronen är eller inte.
Det kan tjäna dig: Vilka är de negativa effekterna vi har med vattenlöslighet?Exempel på differentiella elektroner i flera element
Klor
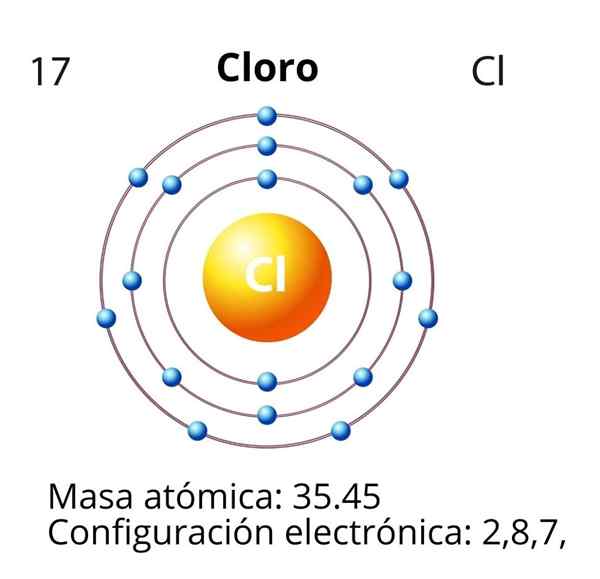
När det gäller klor (CL) är dess atomnummer Z lika med 17. Den elektroniska konfigurationen är då 1s22s2sp63s23p5. Orbitaler markerade i röda motsvarar de i Valencia -lagret, som presenterar nivå 3 öppen.
Differentialelektronen är den sista elektronen som placeras i den elektroniska konfigurationen, och kloratomen är den för 3p -orbital, vars disposition är som följer:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Med respekt för diskbänksregeln fylls först 3P -orbitalerna med lika energi (en uppåt pil i varje omlopp). För det andra parar de andra elektronerna med ensamma vänster till höger elektroner. Differentialelektronen representeras i en grön ram.
Således har den differentiella elektronen för klor följande kvantantal: (3, 1, 0, -1/2). Det vill säga "n" är 3; "L" är 1, orbital "p"; "M" är 0, eftersom det är den omloppande "p" för mediet; Och "s" är -1/2, eftersom pilen pekar ner.
Magnesium
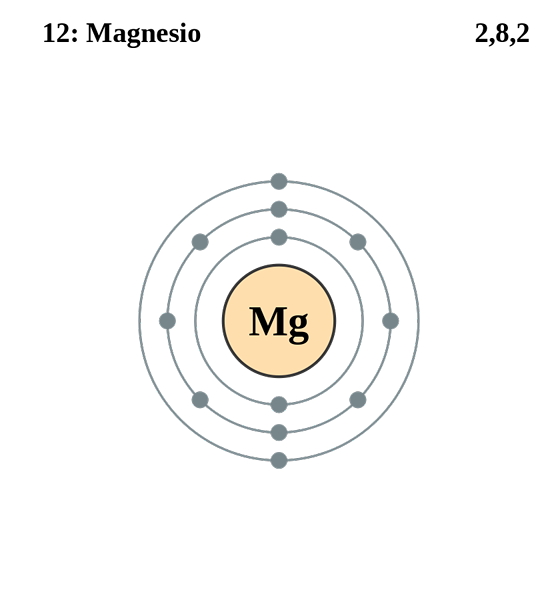 Elektronisk magnesiumkonfiguration. Källa: Electron_Shell_012_Magnesium.SVG: Pumbaa (originalverk av Greg Robson) Derivatarbete: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Elektronisk magnesiumkonfiguration. Källa: Electron_Shell_012_Magnesium.SVG: Pumbaa (originalverk av Greg Robson) Derivatarbete: Kizar, CC BY-SA 3.0, via Wikimedia Commons Den elektroniska konfigurationen för magnesiumatomen är 1s22s2sp63s2, Representerar orbitalet och dess Valencia -elektron på samma sätt:
↑ ↓
3s
0
Den här gången har den differentiella elektronen kvantnummer 3, 0, 0, -1/2. Den enda skillnaden i detta fall med avseende på klor är att kvantantalet "L" är 0 eftersom elektronen upptar en orbital "S" (3s).
Zirkonio
Den elektroniska konfigurationen för zirkoniumatomen (övergångsmetall) är 1s22s2sp63s23p64S23D104p65S24d2. På samma sätt som de tidigare fallen är representationen av orbitalerna och elektronerna i Valencia som följer:
Det kan tjäna dig: Cyclopentano (C5H10): Struktur, egenskaper och användningar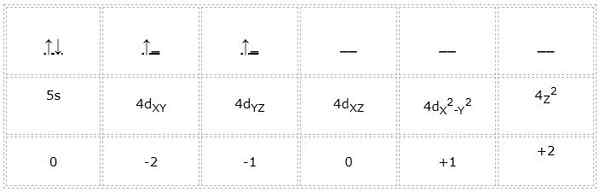
Således är kvantantalet för den differentiella elektronen markerad i grönt: 4, 2, -1, +1/2. Här, eftersom elektronen upptar den andra orbitalen "D", har den ett kvantnummer "M" lika med -1. Eftersom pilen pekar upp är dess spinnnummer "S" lika med +1/2.
Okänt element
Kvantantalet för den differentiella elektronen för ett okänt element är 3, 2, +2, -1/2. Vad är atomantalet z för elementet? Att veta Z kan dechiffrera vad elementet är.
Den här gången, eftersom "n" är samma 3, betyder det att elementet är i den tredje perioden av det periodiska tabellen, med "d" orbitaler som Valencia -skikt ("l" lika med 2). Därför representeras orbitaler som i föregående exempel:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Kvantnumren "M" lika med +2 och "s" lika med -1/2, är nyckeln till att korrekt lokalisera den differentiella elektronen i den sista 3D -omloppet.
Således har elementet som söks 3D -orbitaler10 full, som dess inre elektroniska lager. Sammanfattningsvis är elementet metallzink (Zn).
Kvanttalet för den differentiella elektronen kan emellertid inte urskilja mellan zink och koppar, eftersom detta sista element också presenterar 3D -orbitaler fulla. Därför att? Eftersom koppar är en metall som misslyckas med reglerna för fyllda med elektroner av kvantskäl.
Referenser
- Jim branson. (2013). Sinks regler. Hämtad från kvantumekanik.UCSD.Edu
- Föreläsning 27: Sinks regler. Återhämtad från pH.Qmul.Växelström.Storbritannien
- Purdue University. Kvantantal och elektronkonfigurationer. Hämtad från Murmed.Kem.Purdu.Edu
- Salvat Encyclopedia of Science. (1968). Salvat fysik, s.TILL. av Pamplona Editions, Volym 12, Spanien, s. 314-322.
- Walter J. Moore. (1963). Fysisk kemi. I Partiklar och vågor. Fjärde upplagan, Longmans.

