Calomel elektroddrift, egenskaper, användningar

- 3724
- 454
- Johan Gustafsson
han Kalomelelektrod O Calomelanes är en sekundär elektrod som gör det möjligt att bestämma semi -livspotentialer, tack vare reaktionen som inträffar mellan kvicksilver och kvicksilverklorid (I), HG2Kli2, Tidigare känd som Calomel. Båda reagens, Hg och Hg2Kli2, De vinner eller förlorar elektroner beroende på mediet där elektroden är nedsänkt.
Normalt förkortas som EC, ersätter denna elektrod i många mätningar till standardvätelektroden (hon), eftersom det är lättare att bygga och mindre riskabelt att manipulera (trots att de har kvicksilver). Inuti innehåller den en KCL -lösning som ett elektrolytiskt medium för elektronflöde.
 Calomelelektrod i full mätning. Källa: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Calomelelektrod i full mätning. Källa: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons Calomel Electrode kan ha olika varianter beroende på dess storlek, eller viktigare, av KCL -koncentration. När KCL -lösningen är mättad pratar vi om en elektro från Saturado Calomel (ESC). ESC är lättare att förbereda än EC, men mer känslig för temperaturförändringar.
Användningen av denna elektrod har tillåtit att bestämma halvlivspotentialerna för otaliga redoxreaktioner. Det är också en återkommande anordning i potentiometriska bestämningar, som försöker veta mängden analyt beroende på cell och uppmätt potential.
[TOC]
Fungerande
Så att Calomels elektrod fungerar, HG-HG-paret2Kli2 Du måste reagera, vare sig att vinna eller förlora elektroner.
Katodisk
När reduktionen eller förstärkningen av elektroner sker inuti Calomel -elektroden har vi följande reaktioner:
Hg2Kli2 → Hg22+ + 2cl- (Jonisering)
Hg22+ + 2e- → 2 hg (reduktion)
Hg2Kli2 + 2e- → 2Hg +2Cl- (Nettoreaktion)
Kan tjäna dig: exoterm reaktionDärför hg2Kli2 Vinn elektroner som minskar till metallisk kvicksilver.
Elektrodens potentiella E när reduktionen inträffar ges av ekvationen:
E = eº - 0.0591 log [Cl-]
Där det observeras att det uteslutande beror på koncentrationen av Cl -jonerna-, Att vara standardreduktionspotentialen för denna uppmätta elektrod framför standardvätelektroden.
Anodisk
Inom elektroden kan en oxidationsprocess också uppstå:
2Hg → Hg22+ + 2e- (Oxidation)
Hg22+ + 2cl- → Hg2Kli2 (Nederbörd)
2hg +2cl- → Hg2Kli2 + 2e- (Nettoreaktion)
Det vill säga som kvicksilver oxiderar för att generera mer Hg2Kli2.
Den potentiella E i detta fall ges av:
E = eº + 0.0591 log [Cl-]
Och igen, och det beror på [cl-].
Allmän reaktion
Den allmänna reaktionen för Calomels elektrod är:
Hg2Kli2(s) + 2e- ⇌ 2Hg (L) + 2Cl-
Balansens känsla beror på mediet där elektroden är i kontakt. Cl- Bestäm lösligheten för HG2Kli2, som i sin tur påverkar bildningen eller oxidationen av HG.
Och den potential som bestäms för en viss koncentration av CL -joner- Det kommer att vara lika med:
OCHkalomel = Erutnät - OCHoxe
Vara ekalomel Potentialen som rapporteras som referens i vissa potentiella tabeller.
Egenskaper för kalomelelektroden
Representation av semi
Calomel Electrode Semi -Edge kan representeras enligt följande:
Pt | Hg | Hg2Kli2| Kli- (Xm)
Där bara koncentrationen av Cl -joner är viktig-, uttryckt i molaritet eller normalitet. Elektrodens potentiella E varierar om den är fylld med lösningar med olika KCL -koncentrationer.
Till exempel en EC med KCl 0.1 m har en och lika med 0.3356 V vid 25 ° C; Medan ESC, med mättad KCl, har en och lika med 0.2444 V vid samma temperatur.
Kan tjäna dig: Isopentano: struktur, egenskaper, användningar, erhållaDärför är KCL -koncentrationen den viktigaste egenskapen hos kalomelelektroder, eftersom den kommer att indikera vad man ska använda när beräkningarna av potentiometriska mätningar utförs.
Kommersiellt uppnås tre typer av kalomelelektroder: mättad (ESC), den nittonde (0.1 n eller 0.1 m kcl) och den normala (1 N eller 1 M KCl). En elektrod av kalomel 1 M KCl skulle representeras som:
Pt | Hg | Hg2Kli2| Kli- (1 m)
Fester
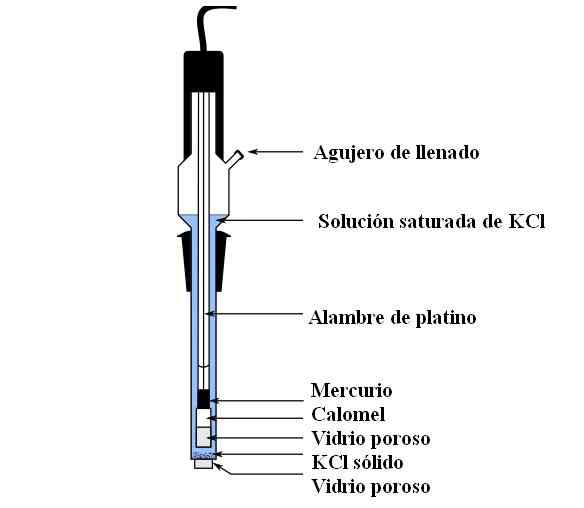 Calomelelektroddelar. Källa: Bachi-Bouzou, CC0, via Wikimedia Commons
Calomelelektroddelar. Källa: Bachi-Bouzou, CC0, via Wikimedia Commons I den övre bilden visar vi huvuddelarna i en vanlig kalomelelektrod. Den är gjord av glas och består av två behållare: en extern, som läggs i elektrokemisk kontakt med mätningens medium och innehåller KCL -lösningen; Och en inre, där HG-HG-blandningen vilar2Kli2.
Internt innehåller Calomel -elektroden flytande kvicksilver, på vilken en Hg -pasta följs2Kli2 fuktad av kvicksilver. Detta är den mest aktiva fasen i elektroden. Det porösa glaset används för att endast tillåta inloppet eller utgången för CL -jonerna-, Men inte HG: s kristaller2Kli2 eller kvicksilverdroppar.
En platinakabel, där elektroner flödar, är nedsänkt i kvicksilver och ansvarar för att ansluta elektroden till voltmetern och den externa kretsen i fråga.
Genom fyllningshålet hälls KCL -lösningen, som innehåller upplösningar av salt. Under tiden har vi en mycket liten öppning i ett poröst glas, som kommer i direktkontakt med mätmediet med mätningsmediet. Syftet med det porösa glaset är att tillåta kontakt utan oönskade utbyten av ämnen som förorenar elektroden eller provet.
Det kan tjäna dig: Cyclohexen: Struktur, egenskaper, syntes och användningarFördelar
Calomel -elektroden presenterar följande fördelar med avseende på standardvätelektroden:
-Lätt att bygga och manipulera
-Dess cellpotential förblir konstant även om vattnet förångas
-Du behöver inte en saltlösningsbro
ESC är det enklaste att bygga från Calomel -elektroder, eftersom KCl räcker för att lösa upp tills deras kristaller bildas. Då kommer lösningen att vara mättad och redo att tappa in i elektroden.
Nackdelar
Calomels elektrod presenterar emellertid följande nackdelar:
-Genom att innehålla flytande kvicksilver kan det utöva en negativ inverkan på miljön
-Det kan inte användas för kvantitativa analyser i prover med en temperatur större än 60 ºC, eftersom HG2Kli2 börjar bryta ner, vilket får elektrodavläsningar att misslyckas
ESC har också nackdelen att det är mycket känsligt för temperaturförändringar.
Silver Silver Electrode har ersatt Calomel i många av de potentiometriska bestämningarna.
Ansökningar
Calomels elektrod är en av de många elektroderna som används dagligen i potentiometriska bestämningar, vilket gör att de semi -livspotentialerna för analytter eller arter av intresse arter eller arter.
Calomel -elektroden används också i pH -mätningar och cyklisk voltmetri.
Referenser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kemi (Femte ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Mättad kalomelektrod. Hämtad från: i.Wikipedia.org
- Generalic, ENI. (20 oktober 2018). Elektrodkalomel. Kroatisk England kemi ordbok och ordlista. Ktf-split. 30 oktober. 2020. Återhämtad från: ordlista.Periodni.com
- Skoog d.TILL., West D.M. (1986). Instrumentalanalys. (Second ED.). Mellanamerikansk., Mexiko.
- Kullar, g., Ives, D. T. (1950). Calomel -elektroden. Natur 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 december 2012). Potentiometri (ii): elektroder. Hämtad från: triplenlace.com
- « Socio -kritiska paradigmegenskaper, metoder, representanter
- Potentiometri grunder, ekvationer, elektroder »

