Potentiometri grunder, ekvationer, elektroder

- 5071
- 1133
- Erik Eriksson
De Potentiometri Det är en elektrokemisk analysteknik som är baserad på mätning av spänning, av ett medium eller fack, med vilken aktiviteten eller koncentrationen av en art (jonisk eller molekyl) av intresse bestäms. Det är en icke -destruktiv teknik, eftersom den inte försöker ändra den kemiska karaktären hos analyten i fråga.
För att utföra denna analys är minst två elektroder oumbärlig: en referens och en annan indikator eller arbete. På samma sätt måste det finnas en hög impedansvoltmeter, med vilken spänningarna mäts utan att tillåta ett märkbart elektronflöde mellan de två elektroderna och lösningarna som omger dem.
 Allmän representation av de nödvändiga elementen för en potentiometrisk analys. Källa: Gabriel Bolívar.
Allmän representation av de nödvändiga elementen för en potentiometrisk analys. Källa: Gabriel Bolívar. Ovan har vi en allmän representation av församlingen för en potentiometrisk analys. I facket där indikatorelektroden introduceras är den art vars koncentration vi vill bestämma; När vi i referenselektroden har vi en annan lösning, där vi känner till koncentrationerna av dess komponenter.
Den registrerade spänningsavläsningen beror i princip på de intressanta arter som närmar sig indikatorelektroden. Med denna spänning beräknar vi till exempel koncentrationen av denna art2+, Ag+, H+, Na+, K+, Kli-, etc. Potentiometri har därför användningar i klinisk, miljömässig, analytisk och fysikalisk -kemisk kemi.
[TOC]
Grundläggande
Spänningen som bestäms i potentiometriska analyser är cellens ochcell, vilket är skillnaden mellan spänningarna orsakade av de två elektroderna, indikatorn och referensen. Elektroderna är känsliga för aktiviteterna för molekylerna eller jonerna som omger dem, att kunna acceptera elektroner av dem eller tvärtom ge dem.
De två facken är anslutna, så elektrodelektrodflöden där reduktionen inträffar (katod), till elektroden där oxidation (anod) äger rum (anod).
Emellertid är denna överföring av elektroner (eller ström) nästan noll, eftersom annars skulle redoxreaktionerna utvecklas för att helt modifiera koncentrationerna och identiteten hos de involverade arterna.
Kan tjäna dig: vätebromid (HBR)Istället tillåter Voltmeter knappt passagen av elektroner, så att det finns en stabil spänningsavläsning och att cellen kan nå den termodynamiska balansen.
Det sägs därför att potentiometri är en icke -destruktiv teknik, eftersom få joner eller molekyler omvandlas till mätprocessen, som också är reversibel.
Huvudekvationer
Cellpotential
Cellens potential är relaterad till aktiviteterna eller koncentrationerna av arter av intresse genom Nernst -ekvationen:
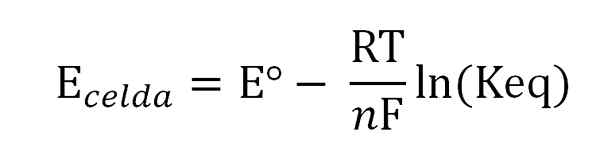 Nernst -ekvation. Källa: Gabriel Bolívar.
Nernst -ekvation. Källa: Gabriel Bolívar. Där eº är potentialen för samma cell i standardförhållanden, för Faraday -konstanten, n Antalet överförda elektroner, r gaskonstanten och keq balanskonstanten för den globala reaktionen. Beräkningarna görs genom att rensa Keq från läsningen av Ecell, och beräkna den önskade koncentrationen av ditt balansuttryck.
Det är dock bekvämt att beräkna koncentrationerna med en enklare väg. Genom konvention ges cellens potential också av följande ekvation:
OCHcell = Erutnät- OCHoxe
Där erutnät Det är potentialen för reduktionssalvedia, där indikatorelektroden är belägen; Medan eoxe Det är potentialen för oxidation av semi -media, där vi har referenselektroden. Således kan ekvationen skrivas om som:
OCHcell = Eindikator - OCHreferens + OCHJ
Vara eJ lika med potentialen som orsakas av ledbryggans leder. I praktiken ochJ Det kan inte fastställas, men se till att dess värde är så minimalt som möjligt med hjälp av mycket utspädda lösningar eller säkerställer att kompositionerna i båda facken är lika.
Analyt
Från föregående ekvation kan vi beräkna ochindikator, Vilket är potentialen som verkligen intresserar oss. Med det värdet tillämpar vi Nernst -ekvationen igen:
Kan tjäna dig: Acetonitrile (C2H3N)OCHindikator = Eº - (rt/nf) ln (röd/ox)
Nätverk är den reducerade formen av analyt eller intresse, och ox är dess oxiderade form. Förutsatt att analyt är katjonerna Zn2+ På en metallisk zinkelektrod skulle vi ha:
OCHindikator = EºZn2+/zn - (Rt/nf) ln (1/tillZn2+)
Var tillZn2+ Det är Zn -katjonaktiviteten2+, som genom experimentella justeringar är ganska nära dess koncentration, [Zn2+]. Från denna ekvation rensas Zn -koncentrationen2+, som kan ses, påverkar direkt värdet på Eindikator.
Den reducerade formen av zink, Zn, presenterar en aktivitet som är lika med 1. Därför kommer den allmänna ekvationen för rostiga katjoner av en metall som fungerar som en elektrod att vara lika med:
OCHindikator = EºMn+/m - (Rt/nf) ln (1/tillM+n)
Men detta gäller endast vid första arterelektroder.
Elektroder
Elektroder, förutom voltmeter, är de viktigaste elementen i alla potentiometriska analyser. Några av dem kommer att nämnas nedan.
Första art
De första arterelektroderna är metaller som oxiderar för att orsaka katjoner och leder elektroner till voltmetern. Några av dessa är följande: Ag, Zn, Cu, HG, SN, TL, CD och BI.
Inte alla metaller fungerar som första klasselektroder, eftersom de inte bör presentera kristallina oegentligheter eller ytor täckta av oxidlager som orsakar instabila spänningar.
Andra arter
Andra arterelektroder är å andra sidan också metalliska, men innehåller också ett salt på deras yta, vars löslighet beror på redoxreaktionerna som äger rum. Till exempel AG-AGCL och HG-HG-elektroder2Kli2 (Calomel), är andra arter elektroder.
Selektiva joner
De selektiva jonelektroderna, även kända som membran, är de som är känsliga för en specifik jon eller molekyl, som smyger genom ett membran utformat endast för honom att passera och inte den andra arten i lösning.
Kan tjäna dig: begränsande och överdrivet reagensFavoritexemplet på denna typ av elektrod är det av glas, byggt för att bestämma koncentrationen av hjoner3ANTINGEN+ eller h+, Och därmed tjäna som en pehometer.
Potentiometri -applikationer
Miljökemi
Potentiometri har använts i miljökemi vid bestämningen av CN -joner-, F- och inte3-, liksom ammoniak i vattenströmmar.
Klinisk kemi
Selektiva elektroder är mycket användbara när mätmediet är komplexa. Därför kommer de andra jonerna eller molekylerna att störa avläsningarna.
Denna egenskap är särskilt fördelaktig i de potentiometriska bestämningar som utförs inom samma celler, där mikroelektroder injiceras för att bestämma K K -koncentrationerna+, Na+, Kli-, Växelström2+ eller h+.
Potentiometriska grader
Anta att i mitten där vi har indikatorelektroden läggs en titel som reagerar med analyt och därför modifierar dess koncentration. Då kommer förändringar att ske i Ecell, som kommer att motsvara på samma sätt till förändring av pH i en syra-bas-titrering.
Således grafering ochcell mot. VTitulant, Vi kan bestämma vändpunkten eller ekvivalensen, och med det kommer vi att veta koncentrationen av analyt.
Potentiometriska grader används allmänt i analytiska och fysikalisk -kemiska kemilaboratorier. Några av de analytter som kan bestämmas med denna teknik är följande: tro2+, Hco3-, Växelström2+, Mg2+, Cu2+, askorbinsyra, haluros, bland andra.
Alla grader kan till viss del följas via potentiometrisk istället för att ta till indikatorerna och deras slutpunkter.
Referenser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kemi (Femte ed.). Pearson Prentice Hall.
- Skoog d.TILL., West D.M. (1986). Instrumentalanalys. (Second ED.). Mellanamerikansk., Mexiko.
- Doktor. Doug Stewart. (2020). Definition av potentiometri. Återhämtat sig från: Chemicool.com
- Harvey David. (5 juni 2019). Potntiometriska metoder. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Britannica Encyclopaedia. (2020). Elektrogravimetri. Återhämtat sig från: Britannica.com
- Wikipedia. (2020). Elektroanalytiska metoder. Hämtad från: i.Wikipedia.org
- « Calomel elektroddrift, egenskaper, användningar
- Stimulerande läkemedeltyper och deras egenskaper »

