Svaga elektrolyterkoncept, egenskaper, exempel
- 2980
- 598
- Anders Larsson
En Svag elektrolyt Det är allt det ämnet som upplöses i vatten inte är helt joniserad. Detta innebär att dess upplösning producerar eller släpper lägre mängder joner än vad som kan förväntas. Denna joniseringsprocess upprättas genom en hydrolysbalans, där joner som H bildas3ANTINGEN+ eller åh-.
Svaga elektrolyter är vanligtvis kovalenta föreningar, vars molekyler tenderar att förbli neutrala utan att förvärva jonbelastningar. Många av dessa elektrolyter består av organiska molekyler med joniserbara funktionella grupper, även om det också finns oorganiska typer, inklusive flera oxacider.

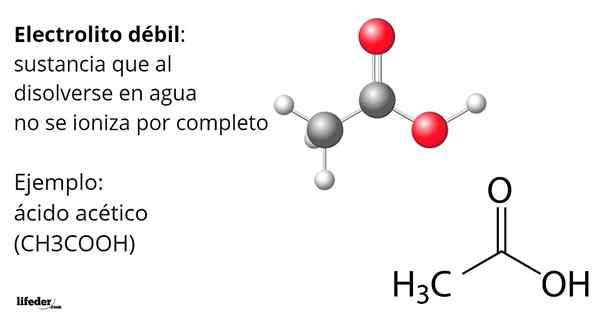
Ättiksyra, cho3COOH, är ett exempel på en svag elektrolyt. Dess molekyl har en funktionell grupp som kännetecknar dess surhet i vatten. Men när inte alla dess molekyler upplöses producerar hjoner3ANTINGEN+ Transformering i acetatanjon, CHO3Kuttra-, Men de förblir neutrala, protonerade.
Vissa elektrolyter är svagare än andra, vilket kommer att bero på graden av deras joniseringar. När de löser upp orsakar de måttliga förändringar i pH. Således har vi sura eller grundläggande svaga elektrolyter.
[TOC]
Egenskaper hos svaga elektoliter
De är kovalenta föreningar
I allmänna termer är svaga elektrolyter kovalenta föreningar, så deras beståndsdelar är molekyler.
De lider hydrolys
Dessa molekyler har förmågan att skaffa joniska belastningar. För att göra detta, delta i en hydrolysbalans, där en vattenmolekyl är "del" i OH-, eller acceptera ett väte för att förvandlas till H3ANTINGEN+.
Ju mindre troliga eller instabil är hydrolys, desto lägre mängder eller koncentrationer av joner som finns i upplösningen av dessa elektrolyter.
De har låg konduktivitet
Lösningarna av svaga elektrolyter är inte så bra elektricitetsledare, jämfört med starka elektrolyter. Detta beror just på det lägsta antalet joner i lösningen, vilket gör det svårt att passera elektronerna genom vatten.
Det kan tjäna dig: mangan eller permangansyraExempel på svaga elektrolyter
 Ättiksyra av äppelvinäger är det mest representativa exemplet på en svag elektrolyt. Källa: Pxhere.
Ättiksyra av äppelvinäger är det mest representativa exemplet på en svag elektrolyt. Källa: Pxhere. Kolsyra
Kolsyramolekylen, h2Co3, Vid upplösning i vatten lider följande hydrolysreaktion:
H2Co3 + H2Eller ⇌ hco3- + H3ANTINGEN+
Problemet är att inte alla h2Co3 Det är joniserat i HCO3-. Dessutom h2Co3 Det är oproportionellt i koldioxid och vatten, vilket ytterligare minskar konduktiviteten hos denna lösning.
För de återstående exemplen kommer detta faktum att återhämta sig: en molekyl, som i princip är neutral, förvärvar jonbelastning, och i processen medierad av hydrolys finns det joner h3ANTINGEN+ eller åh-.
AmonYoVäxelström
Ammoniakmolekylen, NH3, Vid upplösning i vatten lider följande hydrolysreaktion:
Nh3 + H2Eller ⇌ nh4+ + Åh-
Dessa ammoniaklösningar avfyrar en skarp lukt.
Den här gången har vi OH -joner-. Ammoniak är en svag bas, medan kolsyra, en svag syra. Därför klassificeras syror och svaga baser som svaga elektrolyter, eftersom de delvis är joniserade utan att släppa höga koncentrationer av honer h3ANTINGEN+ eller åh-, respektive.
TILLFOSF -syraantingenrik
Fosforsyra, h3Po4, Det är ett exempel på en svag oxoacid, som i sin tur är en elektrolyt:
H3Po4+ H2Eller ⇌ h2Po4- + H3ANTINGEN+
Fosforsyra kan fortfarande drabbas av två andra dissociationer, en för varje syra väte (totalt tre). Koncentrationen av h3ANTINGEN+ Producerad är mindre om den jämförs med en stark oxoacid, såsom salpetersyra, HNO3, vilket är en stark elektrolyt. Ju svagare elektrolyten, desto mindre sur eller grundläggande kommer det att vara.
HydantingenGeno
Vätefluorid, HF, är ett exempel på en oorganisk kovalent förening som, utan att vara oxoacid, är en svag elektrolyt eftersom den är en svag syra. Vid upplösning i vatten produceras fluorhorinsyra, vilket delvis är joniserat:
Kan tjäna dig: kobolthydroxidHF+ H2Eller ⇌ f- + H3ANTINGEN+
Trots att det inte är en stark elektrolyt kan fluoridsyra "äta" det glasmaterial som vanligtvis används för att lagra syralösningar.
Pyridin
Pyridinet, C5H5N, är en amin som är hydrolyserad för att bilda joner oh-:
C5H5N + h2Eller ⇌ C5H5Nh + + Åh-
Pyridin är mer grundläggande än ammoniak, så dess jonisering kommer att vara större och kommer därför att producera större koncentrationer av OH -joner-.
TILLCIANH -syraYoDrico
Cyanhydric Acid, HCN, är också ett annat exempel på en svag syra och elektrolyt:
HCN + H2Eller ⇌ CN- + H3ANTINGEN+
Olösliga salter
Denna punkt är kontroversiell. Hittills har svaga elektrolyter klassificerats som svaga syror eller baser, kännetecknad av deras partiella joniseringar. Emellertid har olösliga salter i vatten, som redan är joniserade i sina kristaller, också betraktats som svaga elektrolyter.
Vid upplösning med svårigheter i vatten är mängden joner som frigörs i lösningen liten jämfört med lösliga salter. I detta avseende producerar olösliga salter mindre ledande lösningar, vilket förmörkar dem lite som starka elektrolyter.
Av denna anledning kommer det här att antas att dessa salter tillhör den svaga elektrolytergruppen, även när upplösning genererar neutrala joner och neutrala molekyler med joniseringsgrader.
Silverklorid
Silverklorid, AGCL, upplöses i vatten för att producera agjoner+ och cl-. Men det är ett ganska olösligt salt. Mängden joner som släpps är mycket lägre än vad som skulle ha om det var helt lösligt, som med silvernitratet, AGNO3, En stark elektrolyt.
Kan tjäna dig: spridd fasKalciumkarbonat
Kalciumkarbonat, caco3, Det är ett olösligt salt som genom att delvis producera ca -joner2+ och co32-. Detta salt, till skillnad från AGCL, är grundläggande, eftersom CO32- är hydrolyserad för att generera joner oh-.
Zinksulfat
Zinksulfat, zonso4, Det är delvis upplöst i vattnet för att producera Zn -joner2+ Och så42-.
Kalciumfluorid
Kalciumfluorid, CAF2, Naturligtvis finns det som fluoritmineral, det löses bara i vattnet för att producera cajoner2+ och f-.
Magnesiumoxid
Magnesiumoxid, Mgo, är en ganska olöslig jonisk förening i vatten. Den lilla delen som upplöses reagerar för att förvandlas till motsvarande hydroxid, Mg (OH)2, vilket är det verkliga ansvaret för utseendet på Mg -jonerna2+ och åh-.
Därför kan Mgo, trots att den är jonisk, inte klassificeras som en stark elektrolyt, för i vattnet släpper den inte joner av sina egna kristaller (MG2+ Jag2-).
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Chung & Chieh. (5 juni 2019). Elektrolyter. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Helmestine, Todd. (11 februari 2020). Svag elektrolytdefinition och exempel. Återhämtat sig från: tankco.com
- Danielle Reid. (2020). Svag elektrolyt: Definition & exempel. Studie. Återhämtat sig från: studie.com

