Inre elektroner

- 665
- 97
- Johan Olsson
Vi förklarar vilka interna elektroner är, deras egenskaper och ger flera exempel
Vad är interna elektroner?
När vi tänker på en atom, föreställer vi oss en kärna som bildas av protoner och neutroner, omgiven av elektronerna som roterar runt den, liknande hur planeterna kretsar kring solen.
Men inte alla elektroner är desamma och två klasser kan särskiljas, beroende på hur nära eller långt de är från atomkärnan.
Vissa är längre från kärnan och kallas Valencia -elektroner. Dessa är ansvariga för alla kemiska reaktioner vi känner. Å andra sidan, De som är närmast kärnan och är starkare förenade med den, är de vi kallar interna elektroner.
Egenskaper hos interna elektroner
De är de mest stabila elektronerna
Som en allmän regel, ju lägre energinivån för en elektron, är detta mer stabilt. Interna elektroner upptar orbitaler vid de lägsta energinivåerna i en atom, därför är de också de mest stabila elektronerna.
De är starkare förenade med kärnan
Kärnan lockar elektroner eftersom båda har motsatta belastningar: kärnan är positiv medan negativa elektroner. Denna kraft ökar när avståndet minskar.
Som en följd av detta är interna elektroner, som är de som är närmast kärnan, också de som är mest kopplade till samma. Av samma anledning är de också de svåraste elektronerna att ta bort.
De är inte en del av de kemiska bindningarna
När en atom närmar sig en annan är det första att röra vid deras yttersta elektroner. Av denna anledning är det bara Valencia -elektroner som ingriper i kemiska reaktioner. Interna elektroner eller deltar i kemiska bindningar, och de är inte heller involverade i någon kemisk reaktion.
Det kan tjäna dig: hur många förvarselektroner har kol?De är väldigt skyddande
Detta innebär att inre elektroner står mellan externa elektroner och kärnan, vilket skapar en slags skärm som minskar kraften som kärnan lockar valens elektroner.
De kommer alltid i par
I varje omlopp finns det bara två elektroner med motsatta snurr, som kallas parade elektroner (vilket är ett annat sätt att säga att de bildar ett par). Som orbitalerna där inre elektroner finns är de alltid helt fulla, så dessa elektroner är alltid parade.
Hur vet vi hur många interna elektroner som en atom har?
Att veta hur många interna elektroner har en atom är mycket enkel. Du behöver bara veta hur många elektroner atomen har, och hur många av dessa elektroner tillhör Valencia -skiktet. Alla andra elektroner är inre elektroner.
Men hur får vi reda på dessa siffror? I följande avsnitt förklarar vi det.
Det totala antalet elektroner är lika med atomantalet
Eftersom atomer är neutrala (det vill säga, de har ingen netto elektrisk laddning), måste de ha samma antal positiva belastningar (protoner) som negativa belastningar (elektroner). Eftersom atomnumret indikerar hur många protoner som finns i kärnan, så indikerar det också hur många elektroner en atom som finns när det är neutralt.
När det gäller joner, som till skillnad från atomer har elektrisk laddning, erhålls det totala antalet elektroner genom att subtrahera atomantalet utom jonbelastningen, med allt och deras tecken.
Exempel
- Kolatomen (c) är elementnummer 6 i det periodiska tabellen (det är dess atomnummer). Därför har kolatomen totalt 6 elektroner.
- Natriumjonen (i) (NA+) har en positiv laddning på +1, och det atomiska antalet natrium är 11. Så det totala antalet elektroner i denna jon är: 11 - (+1) = 10 elektroner.
- Kloridjonen (Cl-) har en negativ belastning på -1, och det atomiska antalet klor är 17. Så det totala antalet elektroner i denna jon är: 17 - ( - 1) = 17 + 1 = 18 elektroner.
Valencias antal elektroner är lika med deras grupp i den periodiska tabellen
Elementen som tillhör grupp 1A (Alkalinmetallerna) har alla en elektron av Valencia. De som tillhör den 2: a (Alkaliner) har 2, de från den 3: e (Boro -gruppen, aluminium, gallium, etc.) De har tre och så vidare. Detta gäller inte för övergångsmetaller.
Liksom tidigare dras jonerna från att beräkna sina valenselektroner.
Exempel
- Syre tillhör grupp 6a för vad som har 6 valenselektroner.
- Sulfidjonen (s2-) Det tillhör också grupp 6a, men har en belastning på -2, så den har: 6 -( -2) = 6 + 2 = 8 Valencia -elektroner.
Exempel på olika atomer och deras inre elektroner
Interna kolelektroner (c)

Som vi såg för ett ögonblick sedan har Carbon totalt 6 elektroner. Dessutom tillhör det grupp 4A för vad som har 4 elektroner i Valencia, så det har totalt 6 - 4 = 2 interna elektroner.
Interna kvävelektroner (N)
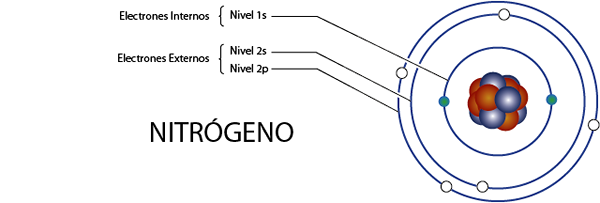
Kväve har totalt 7 elektroner. Dessutom tillhör den grupp 5A för vad som har 5 elektroner i Valencia, så det har totalt 7 - 5 = 2 interna elektroner.
Interna elektroner av argon (AR)
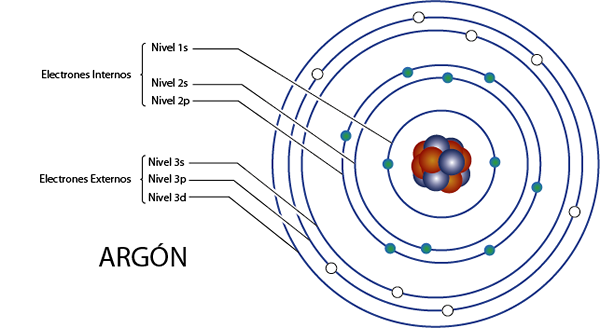
Argon är element 18 för vad som har 18 elektroner totalt. Dessutom tillhör det grupp 8a för vad som har 8 elektroner i Valencia, så det har totalt 18 - 8 = 10 interna elektroner.
Interna elektroner av kloridjonen (CL-)
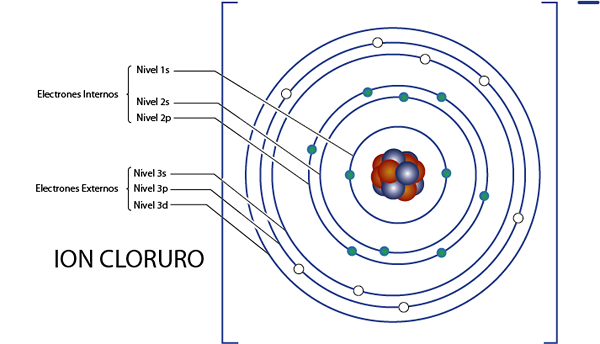
Som vi såg för ett ögonblick sedan har klorid totalt 18 elektroner. Dessutom tillhör den grupp 7A och har laddat -1, så den har 7 - ( - 1) = 8 Valencia -elektroner. Så det har 18 - 8 = 10 interna elektroner, Som argon.
Det kan tjäna dig: kärnkemi: historia, studieområde, områden, applikationerInterna elektroner av kalcium +2 jon (CA2+)
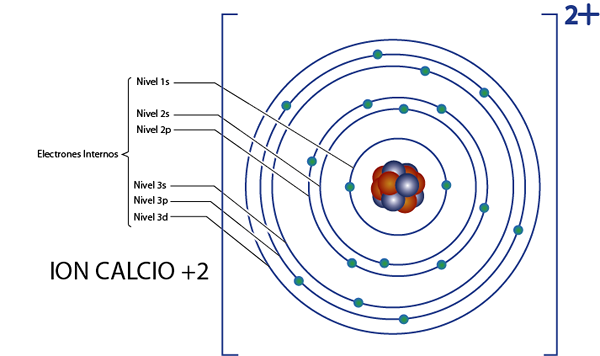
Kalcium är element 20, och denna jon har två positiva laddningar, så den har totalt 20 - 2 = 18 elektroner Runt kärnan. Detta element tillhör grupp 2A och eftersom dess belastning är +2, har det inte valenselektroner (2 - 2 = 0). Av denna anledning är alla 18 elektroner kvar av kalcium de som ursprungligen var de inre elektronerna.
Det finns två element som inte har interna elektroner
De två lättare elementen i det periodiska tabellen, som är väte (H) och helium (HE), har bara 1 respektive 2 elektroner. Båda elektronerna är på den enda energinivån som dessa atomer har, vilket är nivå 1.
Av denna anledning motsvarar dessa elektroner valenselektronerna i dessa två element. Eftersom det inte finns några lägre energinivåer, finns det inte heller några interna elektroner.

