Enantiomerer
- 1008
- 94
- Anders Svensson
Vi förklarar vad enantiomerer och kiralitet, deras egenskaper, nomenklatur och flera exempel är
 Dessa två föreningar är enantiomerer, eftersom de bildas av samma atomer, förenade på samma sätt och är spekulära bilder av varandra
Dessa två föreningar är enantiomerer, eftersom de bildas av samma atomer, förenade på samma sätt och är spekulära bilder av varandra Vad är enantiomererna?
De enantiomerer De är par av föreningar som inte är överflödiga spegelbilder av varandra. Dessa par av föreningar är en viss typ av isomerer, det vill säga de är olika föreningar som har samma molekylformel.
Det finns olika typer av isomerer bland vilka är stereoisomerer, där alla atomer är förenade i samma ordning och med samma typ av länkar, men de har olika inriktningar i rymden (stereo betyder rymd).
Inom stereoisomererna hittar vi enantiomererna, vars huvudkarakteristik är att vara spekulära bilder med varandra.
Enantiomerer är mycket vanliga. Faktum är att nästan alla organiska föreningar som finns i cellerna i alla levande varelser är en av två möjliga enantiomerer.
Till exempel motsvarar alla aminosyror som är en del av naturliga proteiner enantiomer l respektive aminosyran (den andra isomeren identifierar med bokstav D).
Å andra sidan finns de aktiva ingredienserna i de allra flesta mediciner också som par av enantiomerer, varav endast en är effektiv. Svårigheten att separera enantiomerer från varandra innebär att de mediciner som bara innehåller den användbara isomeren är mycket dyra.
Enantiomerer och kiralitet
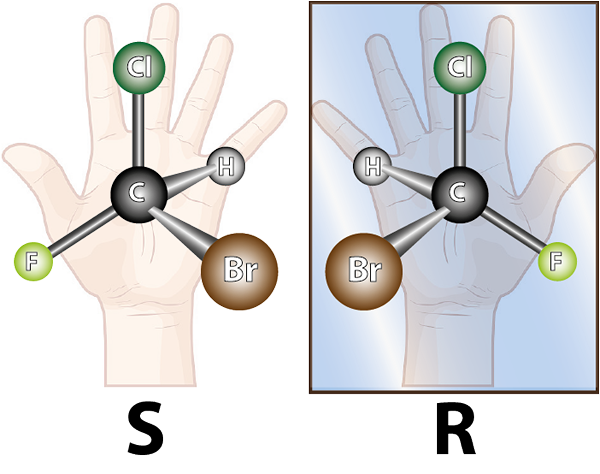
Enantiomerer bildas av kirala molekyler. Chirality är egenskapen att inte vara överlappningsbar med sin spegelbild. Ordet chiral kommer från den grekiska terminen, Kheir vilket betyder hand, att komma ihåg det faktum att händerna också är spekulära bilder av varandra, och de kan inte överlappa varandra.
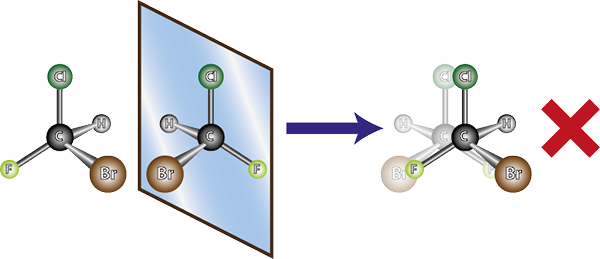 Vänstens molekyl är chiral, eftersom det kan ses när man jämför den med sin spegelbild att de inte överlappar. Med andra ord finns det inget sätt att rotera eller vända det på ett sådant sätt att alla atomer sammanfaller med varandra
Vänstens molekyl är chiral, eftersom det kan ses när man jämför den med sin spegelbild att de inte överlappar. Med andra ord finns det inget sätt att rotera eller vända det på ett sådant sätt att alla atomer sammanfaller med varandra Med tanke på ovanstående kan det dras att för varje kiralmolekyl måste det finnas en annan chiral molekyl som inte är överlappande spegelbild, det vill säga dess enantiomer. Med andra ord, när en molekyl sägs.
Kan tjäna dig: Neodymium: Struktur, egenskaper, användningarChiralcentra
Många chirala föreningar har ett eller flera asymmetriska centra som är ansvariga för molekylens kiralitet. Dessa kallas chirala centra och i många organiska föreningar består av kolatomer som är kopplade till 4 atomer eller grupper av olika atomer.
Den speciella formen eftersom dessa fyra grupper är fördelade kring asymmetriskt kol avgör vilken av de två enantiomererna motsvarar en chiral molekyl. Närvaron av ett enda quiralt centrum säkerställer att molekylen är kiral, men om det finns mer än en kan det vara chiral som det kanske inte.
Enontiomeregenskaper
De flesta fysiska och kemiska egenskaper är identiska
Som höger hand och vänster hand kommer enantiomererna bara i par. Dessa föreningar är praktiskt taget identiska med varandra. Faktum är att de flesta av dess fysiska och kemiska egenskaper såsom fusionspunkt, kokning, ångtryck och löslighet i vissa lösningsmedel, bland andra, är identiska.
Optisk aktivitet
Alla chirala föreningar har en unik egenskap som skiljer dem från dem som inte är: de har förmågan att rotera planet för polariserat ljus. Den här egenskapen kallas Optisk aktivitet, Och det är en av de få egenskaperna som skiljer en kiral förening från dess enantiomer.
Det senare beror på det faktum att det polariserade ljusplanet kan roteras i en av två riktningar, antingen i riktning mot klocknålarna (kallad dextrogyr och representerad med +-symbolen) eller mot klocknålarna (Levógiro, representerade med The the the the the the the the symbol -).
Om en quiral förening kretsar det polariserade ljusplanet i en riktning, kommer dess enantiomer att vända det i motsatt riktning.
-
Exempel
En D-glucosa-lösning kretsar det polariserade ljusplanet i riktning mot klocknålarna (till höger, den är dextrogyral), medan en L-glykoslösning gör att den roterar i motsatt riktning.
Det kan tjäna dig: Erlenmeyer -kolv: egenskaper, användningsområden, användningsmetoderDifferentiell reaktivitet
En annan egenskap som tillåter att skilja en enantión från den andra, är dess reaktivitet mot andra chirala föreningar.
Differentialreaktivitet kan jämföras med hur en handske bara ser bra ut i ena handen, men inte den andra, eller som höger sko passar bra till höger fot, men inte till vänster.
En viktig konsekvens av differentiell reaktivitet är de olika effekterna som kan orsaka de två enantiomererna av vissa mediciner. Dessa skillnader kan vara ofarliga, men de kan också vara mycket farliga.
-
Exempel
- Av de två Enantimers of Aspartame (som är ett konstgjort sötningsmedel) är det ena söt medan den andra inte har någon smak.
- Endast enantiomeren av omeprazol är effektiv som ett gastriskt skydd medan den andra inte ger någon effekt.
- D-penicilamin är en medicin mot reumatoid artrit, medan dess enantiomer, L-penicilamin är ett farligt gift.
Differentiell absorption
Enantiomerer skiljer sig också i hur de absorberas i hartser eller fasta ämnen som också är chiraler. En blandning av enantiomerer kan separeras om den passeras genom en kolonn med chiral separering, eftersom en av de två enantiomererna kommer att absorberas starkare än den andra.
Nomenklatur av enantiomerer
Det finns flera metoder för att identifiera en eller annan enantiomer, men den mest använda är CAHN-ingold-prelog (CIP) -systemet. Detta består av följande steg:
- En hierarknivå tilldelas de fyra grupperna som är kopplade till varje chiral centrum. Gruppernas prioritering tilldelas enligt atomnumret för atomen direkt kopplat till det quirala centret. Om det finns två lika atomer, läggs atomnumren på atomerna som är kopplade till de första för att lägga till atomnumren.
- Riktningen i vilken de tre prioriterade grupperna resas när de lägsta prioriterade punkterna tillbaka bestäms.
- Om ruttens riktning är i riktning mot klockhänderna tilldelas konfigurationen R, Annars tilldelas konfigurationen S.
Exempel
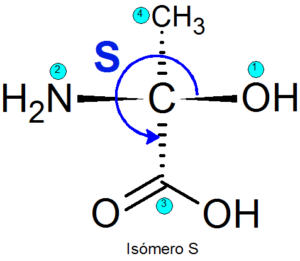
Exempel på enantiomerer
D-glyceraldehyd och l-glyceraldehyd
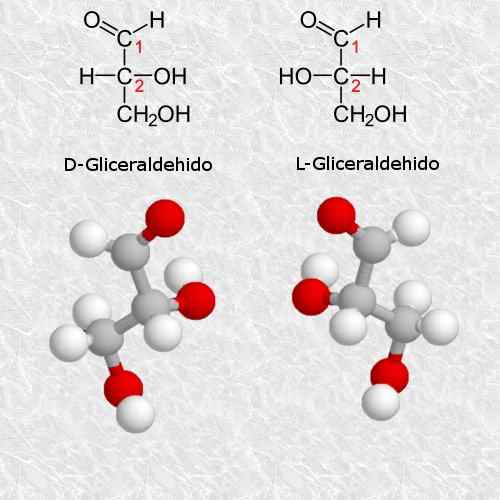
Glyceraldehyd är det enklaste och mest små quirala kolhydratet som finns och är mycket viktigt för kemi och biologi.
Enligt reglerna för Cahn-ingold-prelog-systemet motsvarar D-isomeren isomeren (R) och L-isomeren motsvarar (S) (S).
D-Alanina och L-Alanina
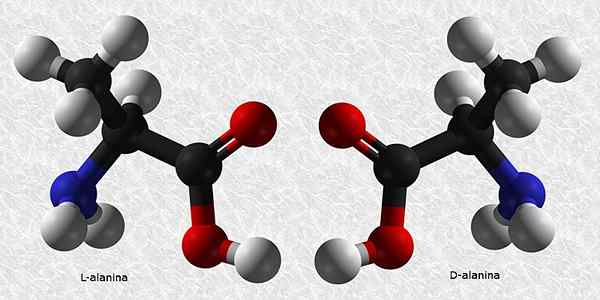
Alanin är en av de essentiella aminosyrorna för konstruktion av proteiner. Liksom nästan alla aminosyror har den ett chiralt kol så att det har två enantiomerer:
Av dessa två är L-Alanina den vanligaste och finns i alla levande varelser, medan D-Alanina bara är närvarande i vissa bakteriecellväggar.
D-tartarisk och L-tartarsyra
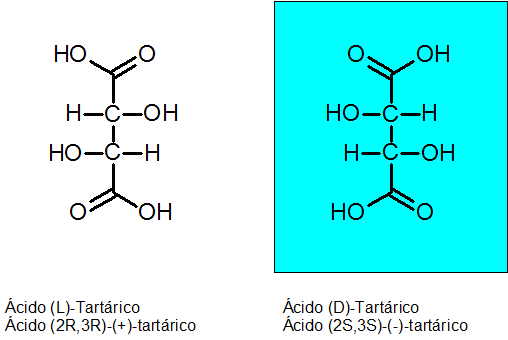
Kiraliteten upptäcktes av Louis Pasteur 1848 tack vare Tartarsyra. Denna förening har 2 asymmetriska kol och kan existera som två enantiomerer plus en tredje isomer som kallas meso -förening.
Den absoluta konfigurationen av de två chirala kolerna är R för Enantiómero Levógiro och S för dextrogyan enantiom.
2-butanol
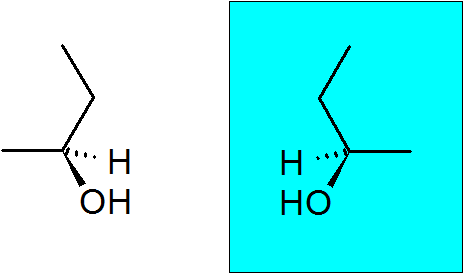
Denna alkohol har också ett quiralt kol, vilket gör att denna förening har två enantiomerer.
Bromokloroetansk
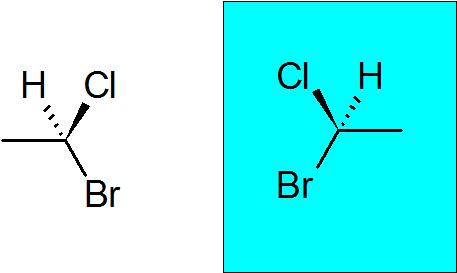
Det är en mycket enkel chiral förening med bara två kolhydrater. Quiral Carbon har anslutit sig till en brom, en klor, en metyl och ett väte.
Referenser
- Chirality (kemi). (18 mars 2021), på Wikipedia.com
- Carey, f. TILL. (2008). Organisk kemi. Boston: McGraw-Hill högre utbildning.
- Smith, m., Mars, j., & Mars, j. (2001). Mars avancerade organiska kemi: reaktioner, mekanismer och struptur. New York: Wiley.
- M.H. Hyun (2012). 8.13 Kromatografiska separationer och analys: Chiral Crown Ether-baserade chirala stationära faser. Redaktör (er): Erick M. Carreira, Hisashi Yamamoto. Förstå chiralitet. Annars. Sidorna 263-285. ISBN 9780080951683,
- Nguyen, l. TILL., Han, h., & Pham-Huy, c. (2006). Chirala läkemedel: En översikt. International Journal of Biomedical Science: IJBS, 2(2), 85-100.

