Joniseringsenergi

- 4050
- 88
- PhD. Emil Svensson
Vad är joniseringsenergi?
De joniseringsenergi, Representerat av Symbol I, det är den minsta mängden energi som krävs för att starta den yttre elektronen till en mol atomer i ett gasformigt tillstånd, i dess grundläggande tillstånd. Med andra ord är det den minsta mängden energi som krävs för att omvandla en mol av neutrala atomer till ett gasformigt tillstånd till en mol av joner med en positiv belastning (därmed dess namn).
Sett i form av en kemisk ekvation skulle joniseringsenergi vara den energi som krävs för följande process:
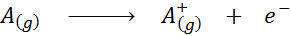
Joniseringsenergi är ett direkt mått på hur starkt de yttersta elektronerna i ett kemiskt element är länkade. När man definierar energin från den gasformiga tillståndsjoniseringsprocessen undviks eller störningen av de intermolekylära interaktioner som förekommer i de flytande och fasta tillstånd.
På detta sätt säkerställs det att joniseringsenergi endast beror på atomens inre krafter och i synnerhet på stabiliteten hos elektronerna som bildar valensskiktet för varje element.
Processen att ta bort en elektron från Valencia -lagret är en process som kräver energi, så det är en endoterm process. Av denna anledning är joniseringsenergier alltid positiva (efter konvention, när energi kommer in i ett system anses vara positivt).
Det finns mer än en joniseringsenergi
Även om definitionen av joniseringsenergi tillämpas på neutrala atomer som blir positiva joner (det vill säga katjoner), kan den också tillämpas på ett successivt avlägsnande av positiva jonelektroner, det vill säga arter som redan har tappat elektroner.
I detta avseende blir energin att jonisera den neutrala atomen bara den första av många möjliga joniseringsenergier, eftersom det finns en för varje elektron som kretsar kring kärnan.
Kan tjäna dig: vad är rörelsens element?Med andra ord betraktas de energier som är associerade med alla följande processer som joniseringsenergier:
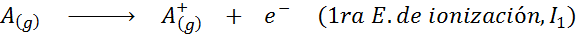
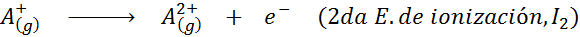
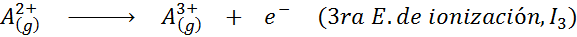
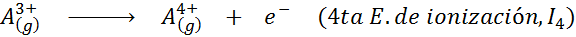
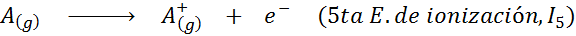
Order av successiva joniseringsenergier
För alla atom av något element uppfylls det att en joniseringsenergi alltid kommer att vara större än alla tidigare joniseringsenergier. Med andra ord, på varandra följande joniseringsenergier har följande förhållande:
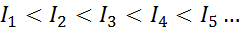
Anledningen till att detta händer är väldigt enkelt. Den första joniseringsenergin innebär att ta bort en elektron till en neutral atom. Men den andra joniseringsenergin innebär att man tar en elektron till en atom som redan har förlorat den första.
Frånvaron av en elektron lämnar en positiv nettobelastning som lockar med mer styrka de återstående elektronerna, så de är svårare att starta. Dessutom minskar denna frånvaro också sköldeffekten som elektroner har på de yttersta elektronerna, så kärnan kan locka dem starkare.
Resultatet är att det är svårare att starta den andra elektronen än den första, och det kommer att vara svårare att starta den tredje än den andra, och så vidare, som kan ses i följande jonisering Energitabell för de första 10 elementen av tabellen periodisk.
Z | Element | Först | Andra | Tredje | Fjärdedel | Femte | Sjätte |
1 | H | 1312 | |||||
2 | han | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Vara | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | ANTINGEN | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Inte | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodisk trend med joniseringsenergi
Jonisering Energi är en periodisk egenskap som ökar från vänster till höger och underifrån till periodisk tabell, vilket kan ses i följande grafik.
Kan tjäna dig: Linjär utvidgning: Vad är det, formel och koefficienter, exempel
Variation av I under en period
När vi flyttar över en period från vänster till höger kallas något effektiva kärnbelastning gradvis, vilket är inget annat än den verkliga positiva belastningen som de yttersta elektronerna kan "se" på grund av skölden för de mest inre elektronerna.
Detta innebär att kraften med vilken kärnan kan locka till sig elektronerna i Valencia ökar, så det blir svårare att riva dem ut och den erforderliga energin (det vill säga joniseringsenergi) blir större.
Variation av i genom en grupp
När vi faller ner i en grupp placerar vi elektroner i ökande energinivåer och därför i atomiska orbitaler allt långt från kärnan. Av denna anledning minskar kraften med vilken kärnan lockar valenselektroner när vi går ner i en grupp, vilket också minskar joniseringsenergin.
Hur man bestämmer joniseringsenergi?
Joniseringsenergi är en experimentellt viss mängd genom en serie tekniker som kallas, tillsammans, fotoelektronspektroskopi.
Dessa tekniker är baserade på ett fenomen som är mycket lik den fotoelektriska effekten, där elektromagnetisk strålning kan starta elektronerna i en atom, och skillnaden mellan strålningsenergi och kinetisk energi som elektron skjuts representerar joniseringenergin.
De olika teknikerna för fotoelektronspektroskopi tillåter analys av energierna som praktiskt taget alla elektron är kopplade till dess kärna, vare sig en elektron av Valencia eller en intern elektron.
Exempel på joniseringsenergi
Första joniseringsenergier av ädla gaser
De ädla gaserna har de mest stabila elektroniska konfigurationerna av alla element i det periodiska tabellen. Av denna anledning har de också de största joniseringsenergierna. Den första joniseringsenergin för var och en av de ädla gaserna presenteras nedan:
-
Helium
Den första joniseringsenergin är 2373 kJ/mol, den högsta i hela periodiska tabellen.
-
Neon
Dess första joniseringsenergi är 2080 kJ/mol och är den näst högsta.
-
Argon
Dess första joniseringsenergi är 1521 kJ/mol. Endast F, NE och han har större joniseringsenergier.
-
Kripton
Den första joniseringsenergin är 1350 kJ/mol. Det är inte så högt som de andra, men det är fortfarande större än för dess närliggande element.
-
Xenon
Samma sak som sägs om Kripton kan sägas om Xenon med sin första joniseringsenergi på 1170 kJ/mol.
Kan tjäna dig: maskhål: historia, teori, typer, bildningFörsta och andra joniseringsenergier av alkaliska metaller
Alkaliska metaller har i sin tur den minsta första joniseringsenergin och den största andra joniseringsenergin i alla element:
-
Litium
Den första joniseringsenergin är mindre än en fjärdedel av den av HE, men litium har den största andra joniseringsenergin i alla element, som är 7300 kJ/mol.
-
Natrium
Natriumet tappar sin första elektron mycket enkelt, eftersom den förvärvar den elektroniska konfigurationen av NE, men för att eliminera den andra elektronen måste du leverera 4560kJ/mol.
-
Kalium
Den första kaliumjoniseringsenergin är endast 418,7 kJ/mol, medan den andra är 3052 kJ/mol, betydligt större än dess grannar.
-
Rubidium
Med en joniseringsenergi på 403 kJ/mol är Rubidio ett av elementen med mindre joniseringsenergi. Den andra är dock 2633 kJ/mol.
-
Cesium
Dess första joniseringsenergi är endast 375 kJ/mol och den andra 2234 kJ/mol, ännu lägre än den första heliumjoniseringsenergin.

