Kovalent bindning
- 4225
- 1256
- PhD. Emil Svensson
Vad är en kovalent länk?
Den kovalenta bindningen är en stark interaktion som gör det möjligt för två eller fler atomer att gå med för att bilda molekyler. Detta är en av de typer av kemiska bindningar där ett par elektroner deltar som kommer från de yttersta orbitalerna i atomerna som är kopplade.
I teorin bidrar varje atom en av de två elektronerna när man länkar kovalent, så att de vinner stabilitet. Paret av elektroner, som blir en slags "elektronisk krok" mellan de två atomkärnorna, delas lika mellan två identiska atomer, men detta händer inte när de två atomerna är av två olika element.
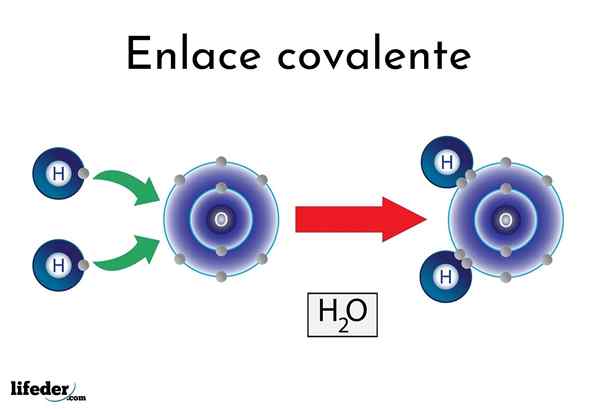
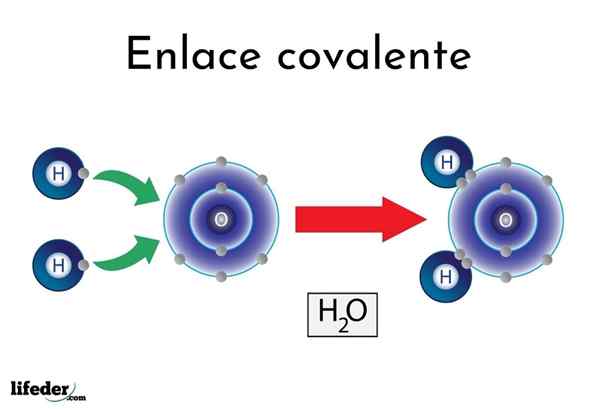 Vattenkovalent bindning
Vattenkovalent bindning Det finns atomer eller element som har en naturlig tendens att ge elektroner, medan andra föredrar att vinna dem.
Till exempel den berömda vattenmolekylen, h2Eller, den har två kovalenta länkar: H-O-H. Hydrogener och syre delar de två elektronpar, men dessa bana närmare syreatomen än väte. Detta fenomen beror på polaritet och elektronegativitet.
Egenskaper hos kovalenta bindningar
De kovalenta bindningarna presenterar följande egenskaper:
-De involverar ett par elektroner för varje kovalent bindning.
-Längderna uttrycks vanligtvis i PM (Picometers) eller Armstrong (Å) -enheter.
-De är svåra att bryta, vilket innebär att de är mycket starka.
-När de går sönder inträffar kemiska förändringar eller transformationer, eftersom molekylen förlorar atomer. I denna process absorberas energi.
-När de bildas föds en ny molekyl. I denna process släpps energi.
Kan tjäna dig: kemiska reaktioner: egenskaper, delar, typer, exempel-Längderna varierar beroende på den aviditet som en av de länkade atomerna har mot paret av elektroner; Det vill säga ju mer den lockar den, den kovalenta länken förlängs.
-De enklaste kovalenta bindningarna finns endast mellan två atomer samtidigt och är representerade med ett skript eller linje (-).
Det finns andra funktioner som gäller mer komplexa kovalenta länkar, som dock också överensstämmer med vad som kommenteras ovan.
Typer av kovalenta länkar
De kovalenta bindningarna kan i princip klassificeras på två sätt: enligt antalet delade elektroner och enligt den resulterande polariteten när molekylen bildas. Båda kommer att beskrivas ytligt under.
Enligt antalet delade elektroner
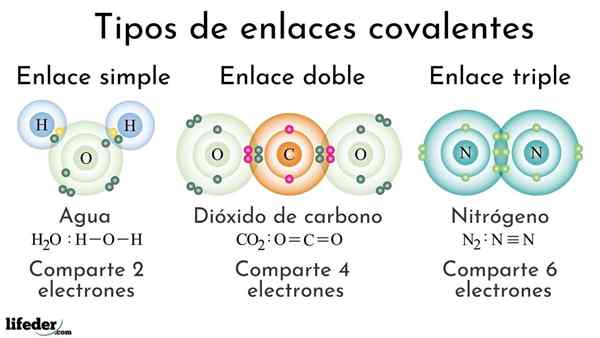 Typer av kovalenta bindningar enligt antalet delade elektroner
Typer av kovalenta bindningar enligt antalet delade elektroner Kovalenta bindningar enligt antalet delade elektroner kan klassificeras som enkla, dubbla eller trippel. I den övre bilden visas dessa respektive länkar för tre molekyler som kommer att diskuteras nedan.
-
Enkel
Den enkla kovalenta bindningen är en där det bara finns ett par elektroner, det vill säga två elektroner. Ett exempel på denna länk som vi ser i vattenmolekylen, h2ANTINGEN. Observera att av alla kovalenta bindningar är det enkla, I-I, den längsta av alla. Detta är nästan alltid.
-
Dubbel
I den dubbla kovalenta bindningen har vi, som namnet antyder, två par elektroner, vilket innebär att det finns fyra elektroner som förstärker den "elektroniska kroken" mellan de två länkade atomerna.
Det vill säga en dubbelbindning (=) är starkare än en enkel (-). Det är emellertid mer reaktivt, som även om det kan verka motsägelsefullt, är lätt att förklara med tanke på överlappningen av atomorbitaler.
Kan tjäna dig: polaritet (kemi): vad är, definition, exempelEtt exempel på denna länk ses i koldioxidmolekylen, CO2. De två syreatomerna förblir starkt förenade till kol tack vare denna bindning, eller = C = O, som, för att vara starkare, närmare atomer; Och i sin tur leder detta till att länken förkortas.
-
Trippel
Triple Link är den starkaste och kortaste av kovalenta bindningar (vanliga). Observera att för kvävemolekylen, n2 eller N≡N, deras atomer representerade av blåaktiga sfärer är mycket nära varandra.
I trippellänken har vi tre elektronpar, vilket är lika med sex elektroner som förstärker den kovalenta bindningen mellan de två atomerna.
-
Dativ
Dativlänken är en speciell typ av enkel länk som består i paret av elektroner kommer bara från en av de två länkade atomerna. Det vill säga, det kunde ses som en "tvingad delning".
Till exempel M -molekylen2Eller använd ett av syrefria par för att donera dem till en jon h+ (H2O: → H+ = [H2ÅH]+ eller h3ANTINGEN+).
Enligt polaritet
Kovalenta bindningar enligt polaritet kan klassificeras som polära kovalent eller icke -polär kovalent.
-
Polära kovalenta bindningar
Det förekommer mellan två olika atomer vars elektronegativitetsskillnad är stor. Detta resulterar i bildandet av en dipol, där en atom koncentrerar sig negativt (lockar elektroner), medan den andra koncentrerar sig positivt (ger elektroner). Till exempel är HF (H-F) kovalent bindning polär, eftersom fluor är mer elektronegativ än väte.
-
Icke -polära kovalenta länkar
Det förekommer mellan två identiska atomer vars skillnad i elektronegativitet är noll eller mycket liten. Molekylerna som nämns ovan: i2, ANTINGEN2 och n2 De presenterar icke -polära kovalenta bindningar. Därför finns elektroner runt båda atomerna med samma frekvens.
Det kan tjäna dig: uretan: struktur, egenskaper, erhålla, användningarExempel på kovalenta länkar
Slutligen kommer andra kovalenta bindningar att listas utöver de som redan förklarats, som också indikerar deras typer:
H2S (H-S-H), enkel polär kovalent | HCl (H-Cl), polär enkel kovalent länk |
H2 (H-H), inte polär enkel kovalent | C2H4 (H-C≡C-H), med två enkla polära länkar (C-H) och en trippel icke-polär länk (C≡C) |
F2 (F-F), enkel icke-polär kovalent | P2 (P≡P), icke -polär (eller apolär) kovalent bindning |
Co₂ (o = c = o), dubbel polär kovalent | S2 (s = s), icke -polär dubbel kovalent bindning |
Hcn (h-c≡N), med en enkel polär kovalent bindning (H-C) och en annan trippel polär länk (C≡N) | NH3 (N-H), med tre enkla polära kovalenta bindningar |
De citerade exemplen motsvarar små molekyler. Men kovalenta bindningar finns i alla befintliga molekyler, inklusive polymerer, biomolekyler, makromolekyler, mineraler, keramik, kolväten, bland många andra.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- María Estela Raffino. (28 juni 2020). Kovalent bindning. Begrepp.av. Återhämtat sig från: koncept.av
- Wikipedia. (2020). Kovalent bindning. Hämtad från: i.Wikipedia.org
- Camy Fung & Nima Mirzaee. (15 augusti 2020). Kovalenta bindningar. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (27 augusti 2020). Vad är en kovalent bindning i kemi? Återhämtat sig från: tankco.com

