Trippel kovalent bindning
- 1649
- 319
- PhD. Emil Svensson
Vi förklarar vad en trippellänk är, dess egenskaper och ger flera exempel
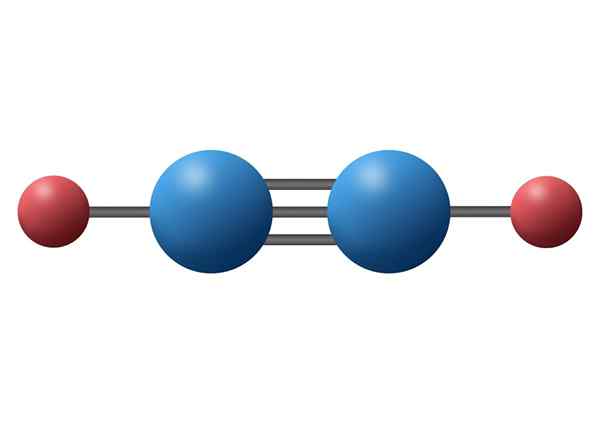 Acetylenmolekyl (C2H2) med sin tredubbla bindning mellan de två kolatomerna
Acetylenmolekyl (C2H2) med sin tredubbla bindning mellan de två kolatomerna Vad är en trippel kovalent länk?
De trippelkovalenta bindningar De är kemiska länkar där två atomer delar tre par elektroner. Med andra ord är de kovalenta bindningar bildade av totalt sex valenselektroner som kretsar kring två atomer.
Det finns många kemiska föreningar som innehåller tredubbla länkar. Till exempel innehåller organiska föreningar som alkyner trippel C-C-kovalenta bindningar. Nitriler kännetecknas också av att ha en grupp som innehåller ett kol kopplat till kväve med hjälp av en trippel C-N-kovalent bindning. Andra oorganiska föreningar såsom molekylär kväve i luften innehåller också tredubbla kovalenta bindningar.
Att ha 6 elektroner som vänder sig om två kärnor ger trippelförbindelser många speciella egenskaper. Både formen på molekylerna som innehåller dem, och de kemiska reaktionerna där de kan delta skiljer sig från dubbla eller enkla bindningar.
Trippel kovalenta länkegenskaper
De bildas av 6 elektroner
Dessa bindningar bildas av 6 elektroner och bildas när var och en av de två involverade atomerna delar tre av dess försvunna elektroner med den andra. Detta är anledningen till att de kallas trippellänkar, eftersom de har tredubbla antalet elektroner i den enkla kovalenta bindningen.
De har en sigma -länk (σ) och två PI (π) länkar
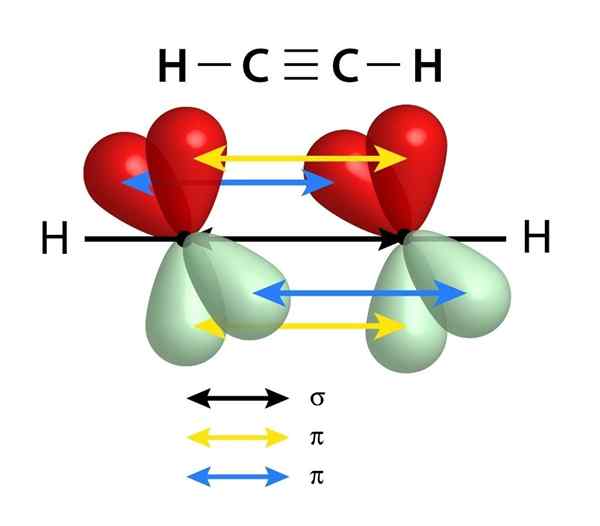 Schema över länkarna som utgör en trippellänk mellan två kolatomer. Centrets svarta pil representerar sigma -länken, medan den gula och blå representerar var och en av de två PI -bindningarna
Schema över länkarna som utgör en trippellänk mellan två kolatomer. Centrets svarta pil representerar sigma -länken, medan den gula och blå representerar var och en av de två PI -bindningarna I likhet med dubbelbindningar bildas trippellänkar också av en sigma -länk som passerar genom mitten av linjen som går med de två länkade atomerna. Till skillnad från de dubbla länkarna som har en har trippellänkarna emellertid två PI -länkar utöver Sigma -länken.
Kan tjäna dig: kopparklorid (I) (CUCL): struktur, egenskaper, användningarDe bildar nästan alltid linjära föreningar
När två kolatomer bildar en trippellänk har var och en fortfarande möjligheten att bilda en ytterligare enkel länk med en annan atom (eftersom kol kan bilda 4 bindningar totalt).
I dessa fall kommer både de två kola och de andra två atomerna fästa vid dem att bilda en rak linje. Denna form som molekylen förvärvar kallas linjär geometri.
De är de starkaste kovalenta bindningarna
När man jämför trippelförbindelserna mellan två atomer med de dubbla och enkla bindningarna mellan samma atomer, observeras att trippelförbindelserna alltid är starkare än de andra typerna av kovalent bindning. Detta innebär att det är svårare att bryta en trippellänk än en dubbel eller enkel.
Detta beror på att dessutom måste bryta sigma -länken (som också finns i både enkla och dubbelbindningar), måste ingen bryta (som i dubbla länkar) utan ytterligare två PI -bindningar.
De är kortare än dubbelbindningar eller så enkla
På grund av samma faktum att vara starkare länkar hanterar trippellänkar.
De representerar två omättnad
Varje kol som har en trippelbindning kommer bara att ha en extra koppling till en annan atom. Detta innebär att sådant kol endast skulle kopplas till två atomer, istället för fyra, så det har mindre väte än det kunde ha om det bara bildade enkla bindningar.
Kan tjäna dig: Heptano (C7H16): Struktur, egenskaper och användningarDetta kallas omättnad, och föreningar med trippellänkar har två omättnad, eftersom var och en av de två kolhydrater skulle passa ytterligare 2 hydrogener, om inte för trippellänken.
De är styva länkar
Som dubbelbindningar är trippellänkar styva och svåra att böja eller vrida. Detta beror på både den större länkkraften och i den lägsta längden.
De kan fungera som baser
Vissa föreningar med trippellänkar kan använda PI -elektronerna för nämnda länk för att länka eller acceptera hjoner+, Därför fungerar som baser.
De kan väte dem för att ge dubbla eller enkla länkar
Ommlingningen av trippellänken kan tas bort genom att bryta PI -bindningarna och lägga till väten till de två kolhydraterna. Detta kallas hydrering. Om bara en vätemolekyl till en trippelbindning läggs till kommer det att bli en dubbelbindning. Om två vätemolekyler tillsätts kommer det att bli en enkel bindning.
Exempel på trippelkovalenta länkar
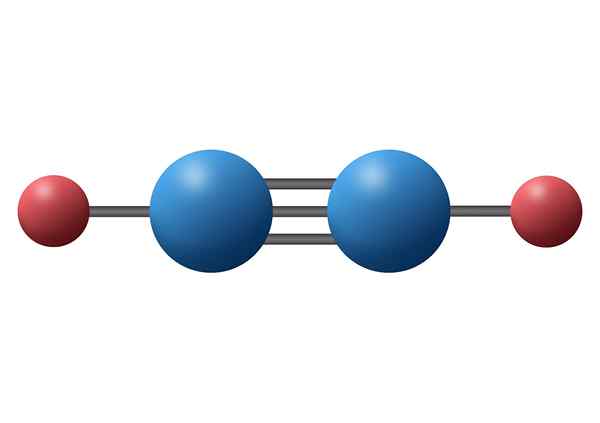
Kvävemolekyl (N2)
Kvävemolekylen innehåller en trippel kovalent bindning mellan de två kväveatomerna. Varje Atom delar sina tre valenselektroner försvann med den andra, och varje nytt par elektroner blir sigmabindningen eller en av de två PI -bindningarna som molekylen har.
 Kvävemolekyl
Kvävemolekyl I det här fallet parar både de två kväveatomerna och de oskadda elektronerna som var och en av dem är belägna längs en rak linje.
Rätt (en alkyn av formel c3H4)
Rätt är den näst enklaste alkynen som finns. Denna förening består av en tre -kolkedja, varav två är kopplade till en trippel kovalent länk.
Kan tjäna dig: omättade kolväten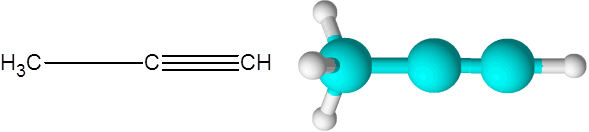 Propinmolekyl
Propinmolekyl Här kan du också se att de tre kolen och den sista väteatomen (den till höger) bildar en rak linje. I modellen kan man också ses att den enkla C-C-länken är längre än Triple C-C-länken.
Kolmonoxid (CO)
Kolmonoxid är en toxisk oorganisk gas som har en negativ kolatom och positivt syre kopplat med hjälp av en trippelkovalent bindning. I det här fallet är det en polär bindning på grund av skillnaden i elektronegativitet mellan kol och syre.
 Kolmonoxidmolekyl
Kolmonoxidmolekyl

