Joniska länkegenskaper, hur former och exempel

- 2032
- 417
- Karl Johansson
han jonlänk Det är en typ av kemisk bindning där det finns en elektrostatisk attraktion mellan joner med motsatt belastning. Det vill säga en positivt laddad jon bildar en länk med en jon som är negativt laddad och överför elektroner från en atom till en annan.
Denna typ av kemisk bindning inträffar när valenselektronerna i en atom överförs permanent till en annan. Atomen som förlorar elektroner blir en katjon (positivt laddad), och den som får elektroner blir en anjon (negativt laddad).
 Exempel på jonbindning: natriumfluorid. Natriumet förlorar en Valencia -elektron och ger den till fluor. WDCF [CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)]
Exempel på jonbindning: natriumfluorid. Natriumet förlorar en Valencia -elektron och ger den till fluor. WDCF [CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)] [TOC]
Jonisk länkkoncept
Den joniska bindningen är den som elektriskt laddade partiklar, kallade joner, interagerar för att ge upphov till joniska fasta ämnen och vätskor. Denna länk är produkten av elektrostatiska interaktioner mellan hundratals miljoner joner och är inte bara begränsad till ett par av dem; det vill säga det går utöver attraktionen mellan en positiv börda mot en negativ belastning.
Tänk till exempel på den joniska sammansatta natriumkloriden, NaCl, känd bäst som bordsalt. I NaCl dominerar den joniska bindningen, så den består av najoner+ och cl-. Då en+ Det är den positiva jonen eller katjonen, medan CL- (Klorid) är den negativa jonen eller anjonen.
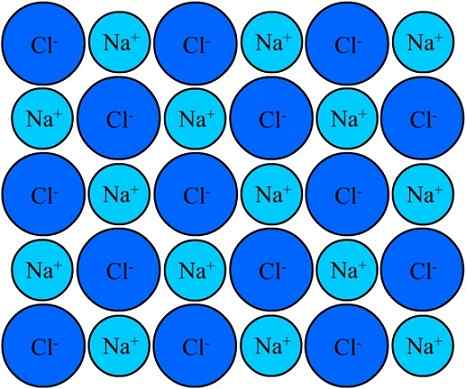 Na+ och cl-jonerna i natriumklorid förblir förenade tack vare den joniska bindningen. Källa: Eyal Bairey via Wikipedia.
Na+ och cl-jonerna i natriumklorid förblir förenade tack vare den joniska bindningen. Källa: Eyal Bairey via Wikipedia. Båda NA+ Som cl- De lockas till att vara motsatta elektriska avgifter. Avståndet mellan dessa joner tillåter andra att närma sig, så att NaCl -par och par dyker upp. Na katjoner+ De kommer att avvisa med varandra för att vara av lika laster, och detsamma händer med varandra med CL -anjonerna-.
Det kommer en tid då miljoner Na -joner+ och cl- De lyckas förena, sammanhängande, för att komma från en så stabil struktur som möjligt; En styrd av den joniska länken (överlägsen bild). Na katjoner+ De är mindre än CL -anjoner- På grund av den växande effektiva kärnkraften i dess kärna på externa elektroner.
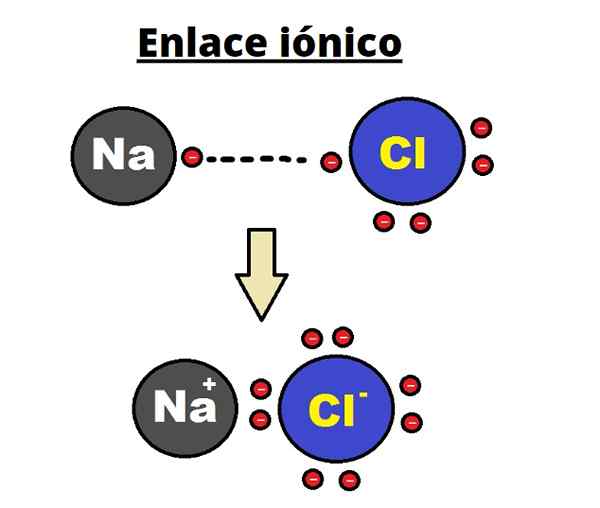 NaCl -jonlänk. Rhannosh/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
NaCl -jonlänk. Rhannosh/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Den joniska bindningen kännetecknas av att etablera ordnade strukturer där avståndet mellan jonerna (NA+ och cl- När det gäller NaCl) är det litet jämfört med andra fasta ämnen. Det talas om en jonisk kristallin struktur.
Hur är en jonisk länk?
Den joniska bindningen sker endast om en elektronfördelning inträffar så att jonbelastningar uppstår. Denna typ av länk kan aldrig uppstå mellan neutrala partiklar. Det måste nödvändigtvis finnas katjoner och anjoner. Men var kommer de ifrån?
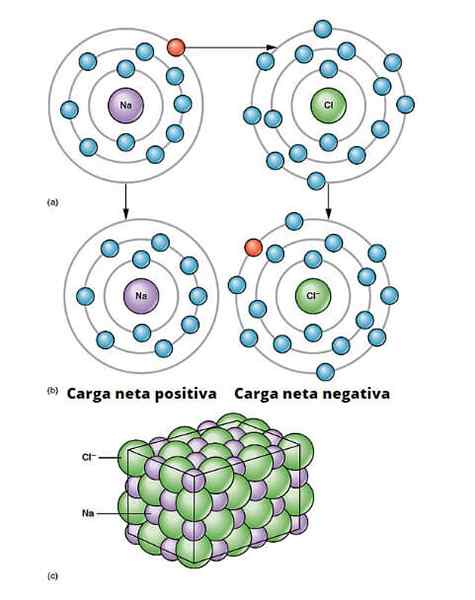 Jonisk länkillustration. a) Natrium har en negativ nettobelastning. b) Natrium ger en elektron till klor. Natriumet är med en positiv netbelastning och klor med negativ nettobelastning, vilket genererar den joniska bindningen. Denna typ av koppling mellan miljoner Na- och CL -atomer ger upphov till fysiskt salt. Openx college/cc av (https: // creativecommons.Org/licenser/av/3.0)
Jonisk länkillustration. a) Natrium har en negativ nettobelastning. b) Natrium ger en elektron till klor. Natriumet är med en positiv netbelastning och klor med negativ nettobelastning, vilket genererar den joniska bindningen. Denna typ av koppling mellan miljoner Na- och CL -atomer ger upphov till fysiskt salt. Openx college/cc av (https: // creativecommons.Org/licenser/av/3.0) Det finns många sätt för vilka joner härstammar, men i huvudsak är många baserade på en oxidationsreduktionsreaktion. De flesta av de oorganiska joniska föreningarna består av ett metalliskt element med ett icke -metalliskt element (de i blocket p av periodisk tabell).
Metallen måste oxidera, förlora elektroner, för att förvandlas till en katjon. Å andra sidan reduceras det icke -metalliska elementet, får dessa elektroner och blir en anjon. Följande bild illustrerar denna punkt för bildning av NaCl från natrium- och kloratomer:
Kan tjäna dig: arseninsyra (H3SO4): egenskaper, risker och användningar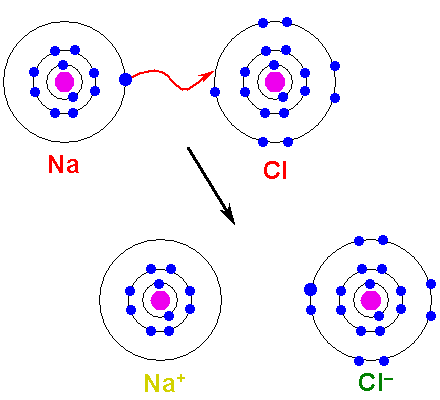 Bildning av en jonisk länk. Källa: Shafei på Arabiska Wikipedia / allmän domän
Bildning av en jonisk länk. Källa: Shafei på Arabiska Wikipedia / allmän domän NA -atomen donerar en av sina Valencia -elektroner till CL. När denna elektronfördelning inträffar bildas najoner+ och cl-, som börjar locka omedelbart och elektrostatiskt.
Det sägs därför att NA+ och cl- De delar inte något par elektroner, till skillnad från vad som kan förväntas för en hypotetisk Na-Cl-kovalent bindning.
Joniska länkegenskaper
Den joniska bindningen är icke -riktad, det vill säga dess styrka är inte närvarande i en enda riktning, men förökas av rymden baserat på de avstånd som separerar jonerna. Detta faktum är viktigt, eftersom det betyder att jonerna är starkt förenade, vilket förklarar flera av de fysiska egenskaperna hos joniska fasta ämnen.
Smältpunkt
Jonbindningen är ansvarig för salt till en temperatur på 801 ºC. Denna temperatur är betydligt hög jämfört med fusionspunkterna för flera metaller.
Detta beror på att NaCl måste ta upp tillräckligt med värme så att dess joner börjar flyta fritt utanför deras kristaller; det vill säga attraktionerna mellan NA måste övervinnas+ och cl-.
Kokpunkt
Fusions- och kokpunkterna för joniska föreningar är särskilt hög produkt av deras starka elektrostatiska interaktioner: deras jonbindning. Men eftersom denna länk involverar många joner tilldelas detta beteende vanligtvis till intermolekylära krafter och inte ordentligt till den joniska bindningen.
När det gäller salt, när NaCl har smälts, erhålls en vätska som består av samma initiala joner; Först nu rör de sig med större frihet. Den joniska länken är fortfarande närvarande. Najoner+ och cl- De möts på vätskans yta för att skapa en stor ytspänning, vilket förhindrar joner från att undkomma gasfasen.
Därför måste smält salt ytterligare öka temperaturen för att koka. NaCls kokpunkt är 1465 ºC. Vid denna temperatur överskrider värmen attraktionerna mellan NA+ och cl- I vätskan, så NaCl -ångor börjar bildas med ett tryck lika med atmosfäriskt.
Elektronnegativitet
Tidigare sades det att den joniska bindningen bildas mellan ett metalliskt element och ett icke -metalliskt element. I sammanfattande konton: mellan en metall och en icke -metall. Vanligtvis är detta i termer av oorganiska joniska föreningar; Framför allt är de av binär typ, till exempel NaCl.
För elektronfördelning (NA+Kli-) och inte en delning (Na-Cl), det måste finnas en stor elektronegativitetsskillnad mellan båda atomerna. Annars skulle det inte finnas någon jonisk länk mellan dem två. Eventuellt NA och CL -tillvägagångssättet, interagerar, men omedelbart CL, för dess större elektronegativitet, "rycker" en elektron till NA.
Detta scenario gäller emellertid endast för binära föreningar, MX, såsom NaCl. För andra salter eller joniska föreningar är deras träningsprocesser mer komplicerade och kan inte tas upp från ett bara atom- eller molekylärt perspektiv.
Det kan tjäna dig: alquinosGrabbar
Det finns inga olika typer av jonbindningar, eftersom det elektrostatiska fenomenet är rent fysiskt och bara varierande hur jonerna interagerar eller antalet atomer de har; det vill säga om de är monoatomiska eller polyiatomiska joner. Dessutom orsakar varje element eller förening en karakteristisk jon som definierar förenings natur.
I avsnittet Exempel kommer denna punkt att fördjupas, och det kommer att ses att jonlänken är densamma i huvudsak i alla föreningar. När detta inte uppfylls sägs det att den joniska bindningen har en viss kovalent karaktär, vilket är fallet med många övergångsmetaller, där anjonerna samordnas med katjoner; Till exempel fecl3 (Tro3+-Kli-).
Exempel på joniska länkar
Flera joniska föreningar kommer att listas nedan, och deras joner och proportioner kommer att markeras:
- Magnesiumklorid
Mgcl2, (Mg2+Kli-), I en 1: 2 -proportion (mg2+: 2 cl-)
- Kaliumfluor
Kf, (k+F-), I en 1: 1 -andel (k+: F-)
- Natriumsulfid
Na2S, (na+S2-), I en proportion 2: 1 (2: a+: S2-)
- Litohydroxid
Lioh, (li+Åh-), I en 1: 1 -andel (LI+: Åh-)
- Kalciumfluorid
Kaf2, (AC2+F-), I en 1: 2 -proportion (CA2+: 2f-)
- Natriumkarbonat
Na2Co3, (Na+Co32-), I en proportion 2: 1 (2: a+: Co32-)
- Kalciumkarbonat
Tjuv3, (AC2+Co32-), I en 1: 1 -proportion (CA2+: Co32-)
- Kaliumpermanganat
Kmno4, (K+Mne4-), I en 1: 1 -andel (k+: MN4-)
- Kopparsulfat
Cuso4, (CU2+Sw42-), I en 1: 1 -andel (CU2+: Så42-)
- Bariumhydroxid
BA (OH)2, (BA2+Åh-), I en 1: 2 -andel (BA2+: Åh-)
- Aluminiumbromid
Alba3, (Till3+Bras-), i en 1: 3 -andel (till3+: 3br-)
- Järnoxid (iii)
Tro2ANTINGEN3, (Tro3+ANTINGEN2-), I en proportion 2: 3 (2FE3+: 32-)
- Strontiumoxid
Sro, (sr2+ANTINGEN2-), I en 1: 1 -proportion (SR2+: Antingen2-)
- Silverklorid
Agcl, (ag+Kli-), I en 1: 1 -andel (Ag+: Cl-)
- Andra
-Ch3Cona, (välj3Kuttra-Na+), I en 1: 1 -andel (Cho3Kuttra-: Na+)
- Nh4I H4+Yo-), I en 1: 1 -andel (NH4+: Yo-)
Var och en av dessa föreningar presenterar en jonisk bindning där miljoner joner, motsvarande deras kemiska formler, lockas elektrostatiskt och har sitt ursprung ett fast ämne. Ju större storleken på dess joniska belastningar, desto mer intensiv kommer attraktionerna och elektrostatiska avstötningar att vara.
Därför tenderar en jonisk bindning att vara starkare ju större avgifterna för jonerna som utgör föreningen.
Kan tjäna dig: alkenesLöst övningar
Vissa övningar som sätter den grundläggande kunskapen om den joniska länken kommer att lösas nedan.
- Övning 1
Vilken av följande föreningar är joniska? Alternativen är: hf, h2Eller, nah, h2S, nh3 och Mgo.
En jonisk förening måste ha en jonisk bindning per definition. Ju större skillnaden i elektronegativitet bland dess komponentelement, desto större är den joniska karaktären på nämnda länk.
Därför kasseras alternativ som inte har ett metalliskt element i princip: hf, h2Eller, h2S och nh3. Alla dessa föreningar bildas endast av icke -metalliska element. Katjonen NH4+ Det är ett undantag från denna regel, eftersom den inte har någon metall.
De återstående alternativen är NAH och MGO, som har Na- och Mg -metaller, förenade till icke -metalliska element. Nah (na+H-) och Mgo (mg2+ANTINGEN2-) De är joniska föreningar.
- Övning 2
Tänk på följande hypotetiska förening: Ag (NH4)2Co3Yo. Vilka är dina joner och i vilken andel som finns i det fasta?
Sönderdela föreningen på sina joner vi har: Ag+, Nh4+, Co32- och jag-. Dessa förenas elektrostatiskt efter proportionen 1: 2: 1: 1 (Ag+: 2nh4+: Co32-: Yo-). Betyder att mängden katjoner NH4+ Det är dubbelt så för agjoner+, Co32- och jag-.
- Övning 3
Vilken av följande föreningar förväntas i princip att den starkaste jonlänken hade? Alternativen är: KBR, CAS, NA2Sw4, Cuo, alpo4 och PB3P4.
KBR består av K -joner+ och br-, Med en storlek av belastning. Sedan har CAS ca -jonerna2+ och s2-, Med dubbla storlekar, så att man kan tänka att den joniska länken i CAS är starkare än i KBR; Och också starkare än i NA2Sw4, eftersom den senare består av najoner+ Och så42-.
Både CAS och Cuo kan ha en lika stark jonisk länk, eftersom båda innehåller joner med dubbla storlekar belastningar. Då har vi Alpo4, med joner al3+ och po43-. Dessa joner har trippelstorleksbelastningar, så den joniska länken i Alpo4 Det borde vara starkare än i alla ovanstående alternativ.
Och slutligen har vi vinnaren PB3P4, Tja, om vi antar att det bildas av joner blir de PB4+ Och s3-. Deras belastningar har de största storlekarna; Och därför PB3P4 Det är föreningen som antagligen har den starkaste joniska bindningen.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Jonbindning. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Joniska vs kovalenta bindningar - förstå skillnaden. Återhämtat sig från: tankco.com
- Redaktörerna för Enyclopaedia Britannica. (31 januari 2020). Jonbindning. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Chemicool -ordbok. (2017). Definition av jonisk bindning. Återhämtat sig från: Chemicool.com
- « Granrataria balanserar funktioner, delar och hur man använder den
- Rutherford History Atomic Model, Experiment, Postulates »

