Rutherford History Atomic Model, Experiment, Postulates
- 3230
- 394
- Hans Olsson
han Rutherford Atomic Model Det är beskrivningen av atomen som skapades av den brittiska fysikern Ernest Rutherford (1871-1937) när han 1911 upptäckte atomkärnan, tack vare de berömda dispersionsexperimenten som heter.
Idén om atomen ("odelbar”På grekiska) som den minsta delen av materien var det en intellektuell skapelse född i forntida Grekland, cirka 300 till.C. Liksom så många andra grekiska koncept utvecklas begreppet atom baserat på logik och argumentation, men inte till experiment.
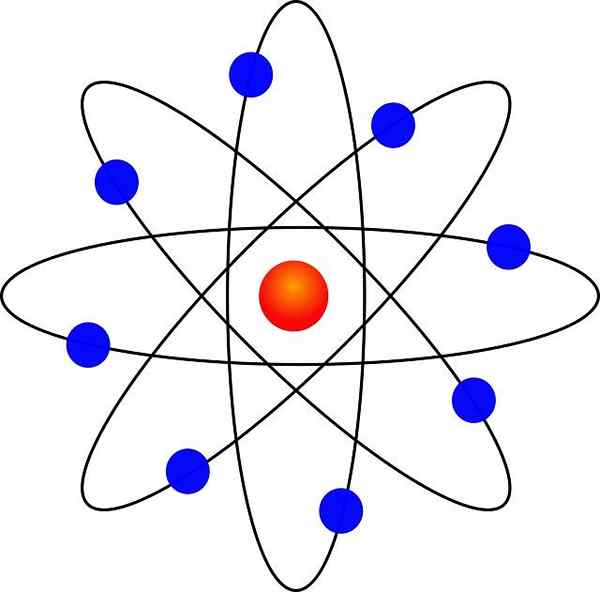
 Rutherford Atomic Model
Rutherford Atomic Model De mest anmärkningsvärda atomistfilosoferna var Democritus of Abdera (460 - 360 f.Kr.), Epicurus av Samos (341 - 270 AC) och Tito Lucrecio (98 - 54 AC). Grekarna utformades fyra olika typer av atomer som motsvarade de fyra elementen som enligt dem bildade saken: luft, vatten, jord och eld.
Därefter skulle Aristoteles lägga till ett femte element: etern som bildade stjärnorna, eftersom de andra fyra elementen var rent markbundna.
Erövringarna av Alexander den stora, av vilka Aristoteles var lärare, utvidgade sin tro för den forntida världen, från Spanien till Indien och därmed i århundraden, idén om atom Han skapade sin egen plats i vetenskapens värld.
[TOC]
Atomen upphör att vara odelbar
De grekiska filosofernas idéer om ämnets struktur upprätthölls som säkra i hundratals år, tills en engelsk kemist och lärare som heter John Dalton (1776-1844) publicerade resultaten av hans experiment 1808.
Dalton enades om att elementen består av extremt små partiklar, kallade atomer. Men det gick vidare genom att säga att alla atomer av samma element är lika, de är samma storlek, samma massa och samma kemiska egenskaper, vilket gör att de förblir oförändrade under en kemisk reaktion.
Detta är den första atommodellen med en vetenskaplig grund. Liksom grekerna fortsatte Dalton att betrakta atomen som odelbar, därför saknade en struktur en struktur. Daltons geni ledde emellertid till att han observerade en av de stora principerna för att bevara fysik:
- I kemiska reaktioner, Atomer skapas eller förstörs varken, De ändrar bara distributionen.
Och etablerade hur kemiska föreningar bildades av ”sammansatta atomer” (molekyler):
- När två eller flera atomer av olika element kombineras för att bilda samma förening gör de det alltid i massproportioner definierad och konstant.
1800 -talet var det stora århundradet av el och magnetism. Några år efter Daltons publikationer såade resultaten från vissa experiment tvivel bland forskare om atomens odelbarhet.
Kan tjäna dig: vad är den kapacitiva reaktansen och hur man beräknar den?Krokrör
Crookes-röret var en enhet designad av brittisk kemist och meteorolog William Crookes (1832-1919). Experimentet som skurkar genomfördes 1875, bestod av att placera, inuti ett rör fullt av gas vid lågt tryck, två elektroder, en som kallas katod Och en annan ringde anod.
Genom att upprätta en potentiell skillnad mellan båda elektroderna, skenade gas med en färg som var karakteristisk för den gas som använts. Detta faktum antydde att det fanns en viss viss organisation inom atomen och att det därför inte var odelbart.
Dessutom producerade denna strålning en svag fluorescens i glasrörets vägg framför katoden, vilket klippte skuggan av ett korsformat märke som ligger inuti röret.
Det var en mystisk strålning känd som "katodstrålar", som reser i en rak linje till anoden och som var mycket energisk, kapabel att producera mekaniska effekter, och som avviks mot en positivt belastad platta eller också med magneter.
Upptäckten av elektronen
Strålning inuti Crookes -röret kunde inte behandlas, eftersom det hade en negativ belastning. Joseph John Thomson (1856 - 1940) fann svaret 1887 när han hittade förhållandet mellan belastningen och massan av denna strålning och fann att det alltid var detsamma: 1,76 x 10elva C/kg., Oavsett gas som är låst i röret eller materialet som används för att tillverka katoden.
Thomson kallade dessa partiklar lik. Genom att mäta sin massa i förhållande till dess elektriska laddning drog den slutsatsen att varje korpuscle var mycket mindre än en atom. Därför föreslog han att de skulle vara en del av dem och därmed upptäcka elektron.
Den brittiska forskaren var den första som redogjorde för en grafisk modell av atomen, genom ritningen av en sfär med infogade punkter, som genom sin form fick beteckningen av "Buddin of Ciruela". Men denna upptäckt gav andra frågor:
- Om saken är neutral och elektronen har en negativ belastning: i vilken del av atomen är den positiva belastningen som neutraliserar elektronerna?
- Om elektronmassan är lägre än atomens, vad består resten av atomen av?
- Varför erhölls partiklarna alltid elektroner och aldrig av en annan typ?
Rutherford -spridningsexperiment: atomkärnan och proton
År 1898 hade Rutherford identifierat två typer av strålning från uran, vilket han kallade alfa och beta.
Naturlig radioaktivitet hade redan upptäckts av Marie Curie 1896. Alfapartiklar har positiv belastning och är helt enkelt heliumkärnor, men vid den tiden var konceptet med kärna ännu inte känt. Rutherford var på väg att upptäcka det.
Kan tjäna dig: termodynamiskt system: egenskaper, typer, exempelEtt av experimenten som Rutherford gjorde 1911 vid Manchester University, med hjälp av Hans Geiger, bestod av att bombardera ett fint guldark med partiklar alfa, vars last är positiv. Runt guldarket placerade en fluorescerande skärm som tillät dem att visualisera effekterna av bombning.
Observationer
Rutherford och dess assistenter studerade effekterna på den fluorescerande skärmen och observerade att:
- En hög andel av alfapartiklar korsade arket utan märkbar avvikelse.
- Vissa avvikde i ganska uttalade vinklar
- Och väldigt lite studsade bakåt
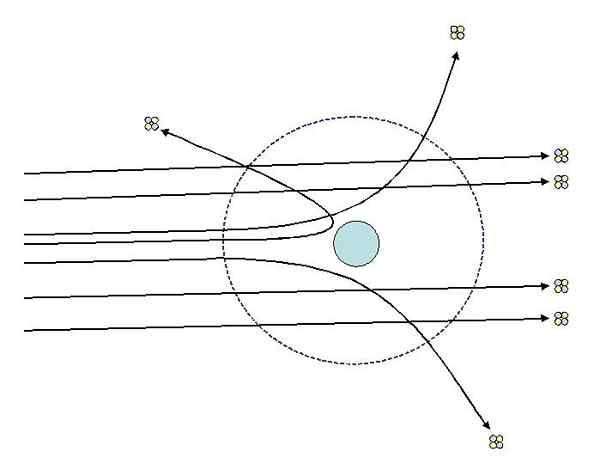 Rutherford -spridningsexperiment. Källa: [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]].
Rutherford -spridningsexperiment. Källa: [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Observationer 2 och 3 förvånade utredarna och ledde dem att anta att den person som ansvarar för de spridda strålarna borde ha en positiv laddning och att den person som ansvarar på observation nummer 1 hade en mycket mindre storlek än den för alfapartiklarna.
Rutherford själv sa i detta avseende att det var "... som om du försökte en 15 -tums marinprojektil mot ett pappersark och projektilen studsade tillbaka och slog dig". Detta kan definitivt förklaras av Thompson -modellen.
Genom att analysera sina resultat från den klassiska synvinkeln hade Rutherford upptäckt förekomsten av atomkärnan, där den positiva bördan av atomen som gav denna neutralitet koncentrerades.
Rutherford fortsatte med sina spridningsexperiment. År 1918 var det nya målet för alfapartiklarna atomerna i gasformiga kväve.
På detta sätt upptäckte det vätekärnor och visste omedelbart att den enda platsen från vilken dessa kärnor kunde komma från kväve själv. Hur var det möjligt att vätekärnor var en del av kväve?
Rutherford föreslog sedan att vätekärnan, ett element som redan hade tilldelats atomnummer 1, skulle vara en grundläggande partikel. jag ringer henne proton, Grekiskt ord för att beteckna först. Således beror upptäckterna av atomkärnan och protonen på denna lysande neozyre.
Postulates Rutherford's Atomic Model
Den nya modellen skilde sig mycket från Thompsons. Dessa var hans postulater:
- Atomen innehåller en positivt laddad kärna, som trots att den är mycket liten, innehåller nästan hela massan av atomen.
- Elektroner kretsar runt atomkärnan på ett stort avstånd och i cirkulära eller elliptiska banor.
- Atomens nettobelastning är tom, eftersom laddningarna för elektronerna kompenserar för den positiva belastningen som finns i kärnan.
Rutherfords beräkningar pekade på en sfärisk kärna och en radio så liten som 10-femton m, är värdet på atomradie cirka 100.000 gånger högre, eftersom kärnorna är relativt mycket avlägsna från varandra: från ordningen 10-10 m.
 Den unga Ernest Rutherford. Källa: Okänd, publicerad 1939 i Rutherford: Att vara Life and Letters of the RT. Hon. Lord Rutherford, eller. M [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)]
Den unga Ernest Rutherford. Källa: Okänd, publicerad 1939 i Rutherford: Att vara Life and Letters of the RT. Hon. Lord Rutherford, eller. M [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)] Detta förklarar varför de flesta alfapartiklar korsade arket utan besvär eller knappast upplevt en mycket liten avböjning.
Sett vid vardagliga föremål skulle Rutherfords atom bestå av en kärna av storleken på en baseboll, medan atomradie skulle vara cirka 8 km. Därför kan atomen betraktas som nästan allt som tomt utrymme.
Tack vare dess likhet med ett miniatyrsolsystem var det känt som "planetmodell av atomen". Den elektrostatiska attraktionskraften mellan kärnan och elektronerna skulle vara analog med gravitationsvakten mellan solen och planeterna.
Begränsningar
Det fanns emellertid vissa oenigheter angående vissa observerade fakta:
- Om idén att elektronbanan runt kärnan accepteras, händer det att elektronen ständigt ska avge strålning tills den kolliderar med kärnan, med den därmed förstörda atomen på mycket mindre än en sekund. Detta, lyckligtvis är det inte vad som egentligen händer.
- Dessutom avger atomen vid vissa tillfällen vissa frekvenser av elektromagnetisk strålning när det finns övergångar mellan ett tillstånd av större energi till en med mindre energi, och endast dessa frekvenser, inte andra. Hur man förklarar det faktum att energi kvantiseras?
Trots dessa begränsningar och att det idag finns mycket mer sofistikerade modeller och enligt de observerade fakta är Rutherfords atommodell fortfarande användbar för eleven att ha en första framgångsrik strategi för atomen och dess beståndsdelar partiklar.
I denna modell av atomen visas inte neutron, en annan beståndsdel av kärnan, som inte upptäcktes förrän 1932.
En kort tid efter att Rutherford föreslog sin planetmodell, 1913 skulle den danska fysikern Niels Bohr ändra honom för att förklara varför atomen inte förstörs och vi är fortfarande här för att berätta den här historien.
Intresseartiklar
Schrödinger Atomic Model.
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Bohr atommodell.
Dalton Atomic Model.
Referenser
- Rex, a. 2011. Fysikens grunder. Pearson. 618-621.
- Zapata, f. 2007. Klassanteckningar för radiobiologi och radiologisk skyddsstol. Public Health School of the Central University of Venezuela.

