Vätebron länk
- 4921
- 984
- Karl Johansson
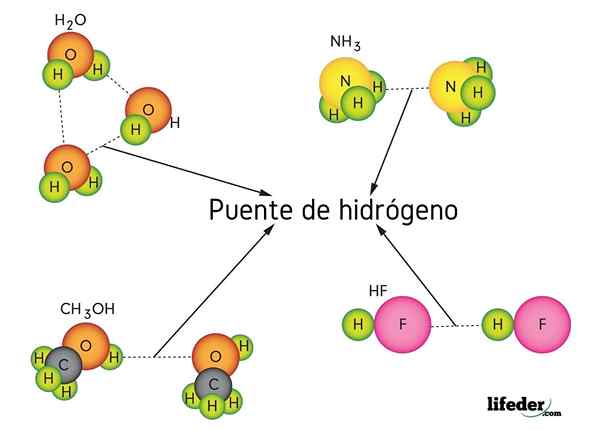
 Vätebrygga i vatten (h2O), metanol (CHO3OH), vätefluorid (HF) och ammoniak (NH3)
Vätebrygga i vatten (h2O), metanol (CHO3OH), vätefluorid (HF) och ammoniak (NH3) Vad är en vätebrygglänk?
Hydrogen Bridge-bindningen är en speciell typ av dipol-dipolo-interaktion som tillhör Van der Waals-krafter, där en väteatom ansluter sig till två eller flera molekyler utan att vara kovalent länkade. Det är inget samtal om ett elektronfack, men om ett huvudsakligen elektrostatiskt fenomen.
Som namnet antyder fungerar väte som en bro, så det måste vara mellan två atomer. Väte är kopplad (H-X) till en mycket elektronegativ atom (såsom N, O och F) och närmar sig en annan elektronegativ atom men från en angränsande molekyl. Detta resulterar i bildandet av vätebron x ··· h-x.
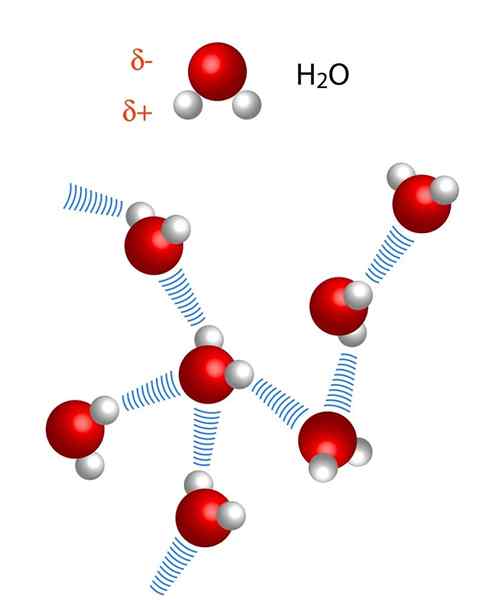
Observera att i X ··· H-X-representationen symboliserar punkterna vätebron, medan skriptet representerar den kovalenta bindningen mellan H och X. Som sagt, låt oss titta på vätebron mellan två vattenmolekyler, där X är syreatomen: h2Eller ··· h-oh (lägre bild).
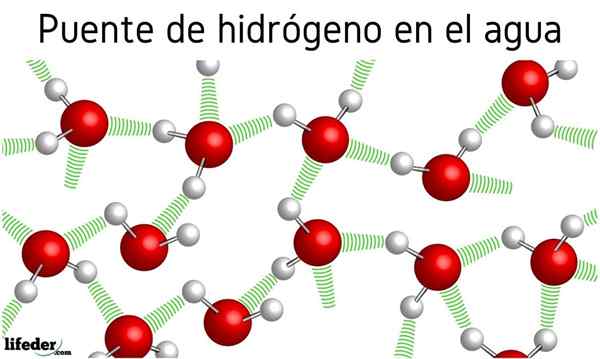
På bilden ovan ser vi att sju vattenmolekyler förblir tillsammans tack vare deras vätebroar, representerade av blå linjer. En vätebro är inte särskilt stark, men när det finns miljarder av dem ger de saken onormala och oväntade egenskaper.
Vätebroets egenskaper
Sammansättning
Vätebron bör verkligen representeras som X '··· H-X, där X är det som kallas vätebryggadonatorn, eftersom den är kovalent kopplad till väte (det ger det).
Samtidigt är X 'acceptorn av vätebron, närvarande i en angränsande molekyl (tar emot den). Således har vi en givaratom (x), en väte (h) och en acceptoratom (x ') som komponerar vätebron (x' ··· h-x).
Geometrisk
När vi tänker på en bro kommer platta eller välvda ytor att tänka på. Eftersom det antas att länkarna inte kurva kommer vi då att ha två avstånd: x ··· h och h-x, som utgör vätebron x ··· h-x.
Kan tjäna dig: irreversibel reaktion: egenskaper och exempelMellan dessa två avstånd finns en vinkel, som ofta är 180 °; Det vill säga de tre atomerna i vår bro vilar på samma horisontella (eller vertikala) linje.
När vinkeln skiljer sig från 180º är X ··· H-X bron inte längre rak eller linjär, men förvärvar andra geometrier.
Å andra sidan är avstånd i vätebroar inte identiska. H-X-avståndet är kortare än x ··· h, som kan ses i bilden av vattenmolekyler. Således är till exempel H-X-avståndet vanligtvis 230 pm (1 · 10-12m), medan det andra avståndet x ··· h är 160 och framåt.
Associativ
Ett speciellt kännetecken för vätebron är att den gör att molekylerna kan vara mycket mer associerade med varandra. De går inte från sida till en annan ignorerar varandra. Därför upprättar den en tillfällig ordning i vätskornas bröst; Och när det gäller fasta ämnen bidrar de till definitionen av sina kristaller.
Där vi ser en vätebro kan vi tänka på förening och därför i en viss ordning (även om de är dynamiska och förändrade) till molekylära skalor.
Energi
Att bryta en vätebro är inte särskilt svårt. Vattenmolekyler, till exempel, gå och skapa varje gång medan du mobiliserar. Men att bryta många av dem samtidigt skulle innebära att man stör ett oändligt antal molekyler. Vi pratar om att leverera en sådan energi som bryter mol av dessa vätebroar (6.02 · 1023 X ··· h-x).
Således varierar kraften i vätebron beroende på molekylernas identitet och natur. Exempelvis behövs kraften i vätebron eller ··· H-O mellan vatten och alkohol 5 kcal/mol: 5 kcal energi för att bryta en mol av den vätebroen i fråga.
Kan tjäna dig: kemiska förändringar: egenskaper, exempel, typerExempel på vätebroar
Vatten
Först talades det om vätebroar mellan vattenmolekylerna, men effekten det har på deras egenskaper nämndes inte. Tack vare dem vatten kokar vid 100 ° C och lämnar kokpunkterna för relaterade molekyler som H2S, som kokar vid -60 ºC; eller h2Jag vet, koka på -41.25 ºC.
Denna avgränsande skillnad beror på vattenvätebroar, som också definierar andra av deras anomala egenskaper, såsom deras enorma specifika värme, iskristaller, deras dielektriska konstant, etc.
Etanol
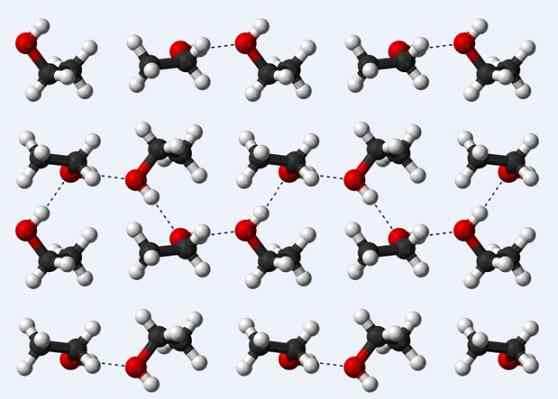 Vätebroar i en etanolkristall
Vätebroar i en etanolkristall Låt oss nu se en annan vätebro: den mellan etanolmolekyler, ch3Ch2Åh (ovan). Observera hur molekylerna rymmer3Ch2Åh på ett sådant sätt att deras vätebroar är etablerade3Ch2Ho ··· hoch2Ch3 (prickade linjer).
Men molekylerna är för ordnade att anta att vi pratar om flytande etanol, men istället utgör ett glas (fast etanol).
Vätebro som beskrivs för etanol liknar den för de andra alkoholerna, med skillnaden att deras kolsyrade skelett kan hindra effektiviteten hos nämnda broar.
Ättiksyra
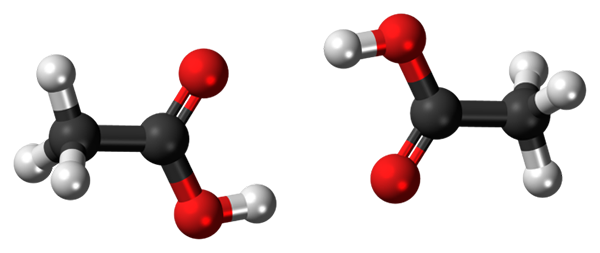 Vätebroar mellan två ättiksyramolekyler. Källa: Jynto, CC0, via Wikimedia Commons
Vätebroar mellan två ättiksyramolekyler. Källa: Jynto, CC0, via Wikimedia Commons Ättiksyra, cho3COOH, kan etablera två vätebroar som förenar två molekyler samtidigt. Eftersom de är två molekyler kopplade av vätebroarna, pratar vi om en dimer.
Observera att en av dessa vätebroar är C = O ··· H-O och den andra O-H ··· O = C. Ättiksyra presenterar den egenhet som i ångfasen finns som denna dimer.
Det kan tjäna dig: mangan eller permangansyraCellulosa
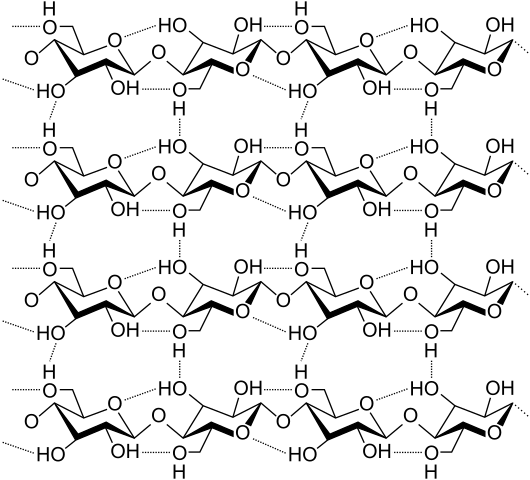 Vätebroar mellan flera cellulosa kedjor. Källa: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Vätebroar mellan flera cellulosa kedjor. Källa: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Låt oss nu se mer olika och flera vätebroar. Cellulosa, en naturlig polymer, består av kedjor som består av flera enheter av ß-glukos.
Varje kedja förblir fast vid en annan tack vare många vätebroar (överlägsen bild), som förstärker sammanhållningen mellan kedjorna.
DNA
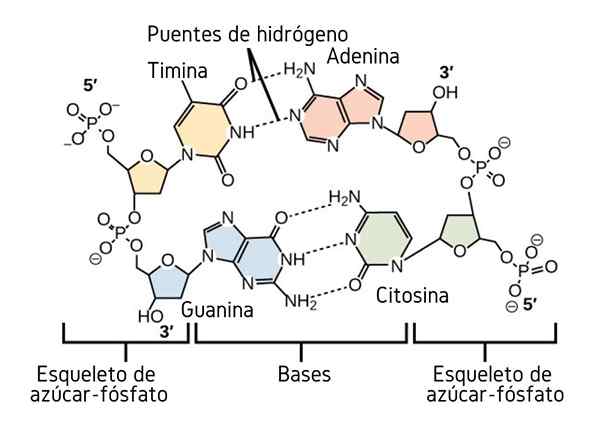 Vätebroar mellan kvävebaserna i DNA. Källa: CNX OpenStax, CC av 4.0, via Wikimedia Commons
Vätebroar mellan kvävebaserna i DNA. Källa: CNX OpenStax, CC av 4.0, via Wikimedia Commons Hittills har vi sett den associerande effekten av vätebroar för att införa ordning mellan molekylerna. Men hur är det med en makromolekyl? I en makromolekyl, såsom DNA, hittar vi inre eller intramolekylära vätebroar mellan dess tymin, adenin, guanin och cytosin (ovan) (ovan) (ovan).
Intramolekylära vätebroar mellan dessa kvävebaspar, gör att DNA -molekylen får en dubbel propellerstruktur, som är idealisk för dess replikering. Om dessa vätebroar bryts av uppvärmning kommer den dubbla propellen att öppna i två enskilda segment eller band.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Edward E. Ávila & Asilé J. Björnbär. (2004). Vätebro och dess applikationer länkar. University of Los Andes, fakulteten för vetenskaper, avdelningen för kemi.
- Wikipedia. (2020). Vätebindning. Hämtad från: i.Wikipedia.org
- Pietri j. & Clark J. (21 augusti 2020). Vätebindning. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Redaktörerna för Enyclopaedia Britannica. (2020). Vätebindning. Återhämtat sig från: Britannica.com
- Helmestine, Anne Marie, PH.D. (29 oktober 2020). Vad är exempel på vätebindning? Återhämtat sig från: tankco.com

