Acid-baser Arrhenius, Bronsted-LoWry Theories, Lewis

- 2167
- 278
- Johan Johansson
 Graf som relaterar de tre huvudsakliga teorierna om syror och baser. Källa: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons
Graf som relaterar de tre huvudsakliga teorierna om syror och baser. Källa: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons Vad är syra- och basteorier?
Syra- och basteorier är en uppsättning konceptuella bidrag som definierar och differentierar syror och baser, två konglomerat av enorma relevansämnen inom kemiområdet.
Dess rötter kommer från de första karaktäriseringarna gjorda av Robert Boyle 1661, som definierade syror som sura och frätande ämnen som ändrar färgen på det blå till rött fjäderpapper; Och baserna som tvålämnen som, till skillnad från syror, ändrar färgen på det röda till blått shin -papper.
Antoine Lavoisier föreslog att alla syror innehåller syreatomer, såsom h2Sw4 och hno3. Århundraden senare 1811 fann Humphry Davy att många syror faktiskt inte hade syreatomer, såsom HCl, HF, HBR, etc.
Och kort före utseendet på den berömda syras-triaden (överlägsen bild) föreslog Justig Liebig att syror har väteatomer som kan ersättas av metallkatjoner.
Denna empiriska kunskap tjänade som inspiration för de aktuella teorierna om syror och baser: Arrhenius, Bronsted-Lowry och Lewis. Som framgår av grafen är Arrhenius teori den mest restriktiva eller begränsade av alla, medan Lewis är den mest allmänna och globaliserade.
Arrhenius teori
Föreslagen av 1884 av Svante Arrhenius, säger hans teori att syror när de upplöstes i vatten producerar joner h3ANTINGEN+ eller h+; Medan baserna, när du löser upp i vatten, producerar eller släpper OH -joner-.
Jonerna h3ANTINGEN+ och åh- De kombineras i en reversibel reaktion som ger upphov till vattenmolekyler:
H3ANTINGEN+ + Åh- ⇌ 2h2ANTINGEN
Kan tjäna dig: Disulfurinsyra: Vad är, struktur, egenskaper, användningarSå en arrhenius -syra är också den som ökar koncentrationen av hjoner3ANTINGEN+, Medan en Arrhenius -bas är en som ökar jonkoncentrationen oh-.
Detta innebär att en Arrhenius -syra inte nödvändigtvis bör innehålla hjoner3ANTINGEN+, Och en Arrhenius -bas behöver inte ha OH -joner- I sin struktur.
Exempel och begränsningar
Tänk på följande dissociationer:
Hcl (ac) → h+(Ac) +cl-(Ac)
NaOH (AC) → NA+(AC) +OH-(Ac)
HCl är en arrhenius -syra eftersom när den är upplöst i vatten producerar den hjoner+, eller mer korrekt, hjoner3ANTINGEN+. Och å andra sidan är NaOH en Arrhenius -bas eftersom när den är upplöst i vatten, OH -joner släpper ut-. Dessa ämnen reagerar på varandra för att producera salt och vatten:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2ANTINGEN
Problemet med Arrhenius -teorin ligger i det faktum att det endast är begränsat till vattenhaltiga lösningar och gäller därför endast för ämnen som är lösliga i vatten. Till exempel är Mgo mycket olöslig i vattnet, och ändå är det en grundläggande oxid.
Det kan inte heller förklara hur ämnen som NH3 och Cao producerar OH -joner- upplöst i vatten, även när de inte har joner oh- I sin molekylära eller kristallina struktur (som är fallet med NaOH eller KOH).
Och han förklarar inte hur CO2 kan frigöra joner h3ANTINGEN+ I vatten utan att ha någon väteatom i sin molekylstruktur (som är fallet med HCl eller H2Sw4).
Brönsted-Lowry Theory
Förslaget individuellt 1923 av Johannes Bronsted och Thomas Lewry, deras teori om syror och baser säger att en syra är allt det ämnet som kan donera joner h+, och att en bas istället är något ämne som kan acceptera dessa h+. Denna teori är mer allmän än Arrhenius och täcker flera av dess begränsningar.
Kan tjäna dig: molära lösningar: koncept, förberedelser, exempelExempel
Tänk på neutraliseringsekvationen mellan H igen3ANTINGEN+ och en oh- För att producera två vattenmolekyler:
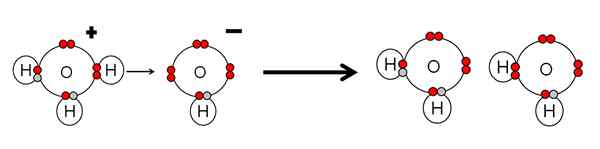 Exempel på syranutralisering och vattenbas. Källa: Gabriel Bolívar.
Exempel på syranutralisering och vattenbas. Källa: Gabriel Bolívar. Observera att h3ANTINGEN+ Gjort en h+ som omedelbart kommer att kopplas eller samordnas med OH- eller hur. När h+ Det slutar kopplat till ett av de elektronfria paren i OH-, Två neutrala vattenmolekyler kvarstår som produkter.
H3ANTINGEN+ Därför är det en brnsted-lowry syra för att donera h+, och oh- Det är en Brnsted-Lowry-bas för att acceptera detta h+.
Ett annat exempel på en syrasreaktion är som följer:
Nh3(g) + HCl (G) → NH4Cl (s)
Denna reaktion, enligt Arrhenius, kunde inte betraktas som syra-bastypen eftersom den inte äger rum i vattenhaltigt medium utan i ångfasen eller i ett gasformigt tillstånd. Nh3 Det är en Brnsted -bas eftersom den accepterar HCL H genom att donera ett par elektroner belägna på kväveatomen; Och hcl, logisk, blir brnsted syran.
Således är Mgo en Brnsted -bas eftersom den kan acceptera H+ av syror för att förvandlas till Mg (OH)2.
Lewis Theory
Bronsted-Lowrys teori förklarar ett brett spektrum av syrasreaktioner. Ignorera emellertid de reaktioner där hjoner+ och åh- De är inte alls involverade, liksom ett större deltagande av fria elektroner i molekylära mekanismer.
1923 g. N. Lewis föreslog en syra-basteori som säger följande: En syra är alla ämnen som kan acceptera par av elektroner, medan en bas är en som donerar dessa elektronpar.
Det kan tjäna dig: DAPI (4 ', 6-diamidino-2-fenylindol): Egenskaper, grund, användningTill exempel jon h+ Det är en Lewis -syra eftersom den accepterar elektronpar av alla arter runt: från h2Eller för att komma från h3ANTINGEN+, av nh3 Att komma från NH4+, etc.
Exempel och fördelar
Tänk på ett annat exempel i följande reaktion:
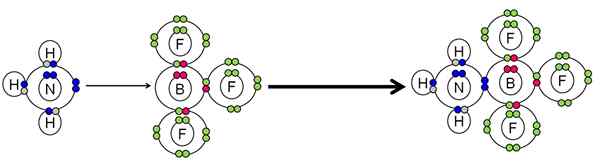 Exempel på neutralisering mellan en syra och en Lewis -bas. Källa: Gabriel Bolívar.
Exempel på neutralisering mellan en syra och en Lewis -bas. Källa: Gabriel Bolívar. Nh3 Gjort ett par elektroner (blå) av kväveatomen till BF -boratomen3. Därför NH3 Det är basen för Lewis eftersom donerar elektronparet och BF3 Det är Lewis syra eftersom han accepterar dem.
I allmänhet är katjoner och fattiga elektronarter Lewis -syror, medan anjoner och elektronrika arter är Lewis -baser.
De fördelar som erbjuds.
Till exempel: h2O Den har gratis elektroner i syre. Om du donerar en av dem till en jon h+, kommer att fungera som en Lewis -bas, som är H+ Följaktligen Lewis -syra.
Enligt Bronsted-Lowry, h2Eller jag skulle agera som bas eftersom den exakt accepterar h+ Genom att donera ett par av sina fria elektroner. Och slutligen, h2Eller det är också en bas enligt Arrhenius teori eftersom koncentrationen av hjoner minskar+ i den vattenhaltiga miljön och därmed öka koncentrationen av OH -joner-.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Clark Jim. (2002). Teorier om syror och baser. Återhämtat sig från: Chemguide.co.Storbritannien
- Broderick c., Moussa m., & Clark J. (21 augusti 2020). Översikt över syror och baser. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wikipedia. (2020). Syrabasreaktion. Hämtad från: i.Wikipedia.org
- Texas A&M University. (s.F.). Syror och baser: Utveckling av syror och baser. Återhämtad från: kem.tamu.Edu

