Reaktionsentalpi, termokemi, övningar

- 4036
- 45
- PhD. Lennart Johansson
De reaktionsentalpi Det är en termodynamisk funktion som gör att du kan beräkna värmen som erhållits eller levereras till en kemisk reaktion, förutsatt att denna reaktion har inträffat vid konstant tryck. Det definieras som inre energi eller plus produkten från trycket P genom volym V i ämnena som är involverade i en kemisk reaktion, enligt följande: H = U + P ∙ V
Därför har entalpi dimensioner av energi, och i det internationella åtgärdssystemet mäts det i Joules. För att förstå förhållandet mellan entalpi med värmen som bytts ut i en kemisk reaktion är det nödvändigt att komma ihåg den första lagen om termodynamik, som fastställer följande: q = ΔU + w
 Figur 1. Vid förbränningen av en gas minskar entalpin. Källa: Pixabay
Figur 1. Vid förbränningen av en gas minskar entalpin. Källa: Pixabay Den första lagen konstaterar att värmen som utbyts i en termodynamisk process är lika med variationen i den inre energin i de ämnen som är involverade i processen plus det arbete som utförs av dessa ämnen i processen.
I alla processer beräknas W -arbetet med följande förhållande:

I det tidigare uttrycket VI är den initiala volymen, vf den slutliga volymen och P trycket. Om processen utförs under konstant tryck P, kommer det resulterande arbetet att vara:
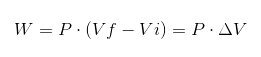
Där ΔV är volymvariationen.
[TOC]
Definition
Kemiska reaktioner är termodynamiska processer som i allmänhet uppstår under konstant tryck och mycket ofta vid atmosfärstryck. Denna typ av termodynamiska processer kallas "isobarisk", eftersom den inträffar vid konstant tryck.
I detta fall kan den första lagen om termodynamik skrivas så här:
Qp = Δu + p ∙ ΔV
Där QP indikerar att värme har bytts ut vid konstant tryck. Om definitionen av entalpi h = u + p ∙ v erhålls då:
Qp = ΔH
Därifrån måste du ändra positiv entalpi indikerar en reaktion som har tagit värme från miljön. Detta är en endoterm reaktion.
Kan tjäna dig: ton: transformationer, ekvivalenser och övningar löstTvärtom, om förändringen av entalpi är negativ är det en exoterm reaktion.
I själva verket kommer ordet entalpi från det grekiska ordet Entalpien, vars betydelse är "värme".
Ofta kallas också entalpin värme. Men det måste vara tydligt att det inte är detsamma som värme, men det är värmeutbytet under den termodynamiska processen som förändrar entalpin.
Värmeförhållande
Till skillnad från värme är entalpi en tillståndsfunktion. När förändringen av entalpi beräknas beräknas skillnaden mellan två funktioner som uteslutande beror på systemets status såsom intern energi och volym.
ΔH = ΔU + P ∙ ΔV
Liksom i reaktionen förblir trycket konstant, så reaktionsentalpin är en tillståndsfunktion som bara beror på intern energi och volym.
I en kemisk reaktion kan reagensens entalpi definieras som summan av var och en av dem; och produkter som summan av entalpin för alla produkter.
Förändringen av entalpi i en reaktion är skillnaden mellan produkterna förutom reagensens:

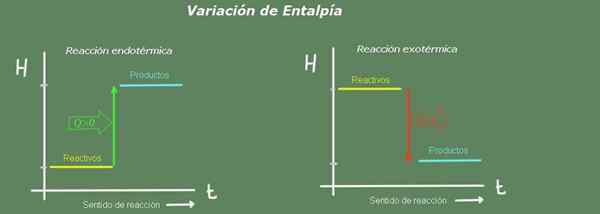 figur 2. Entalpi -diagram. Källa: Självgjord.
figur 2. Entalpi -diagram. Källa: Självgjord. I en endoterm reaktion är produktens entalpi större än reagensen; det vill säga reaktionen tar värme från miljön. Tvärtom, i en exoterm reaktion är reagensens entalpi större än produkterna, eftersom reaktionen ger värmen till miljön.
Standardentalpi
Eftersom förändringen av entalpi i en kemisk reaktion kan bero på tryck och temperatur är det vanligt att definiera standardreaktionsförhållandena:
Det kan tjäna dig: kalibreringskurva: vad är det för, hur man gör det, exempelStandard reaktionstemperatur: 25 ° C.
Standardreaktionstryck: 1 atm = 1 bar.
Standard entalpi betecknas enligt följande: h °
Termokemi
I en termokemisk ekvation spelar inte bara rollreagens och produkter, variationen av entalpi är också viktig. Entalpi förstås som reaktionen på förändringen av henne som hade plats under samma.
Som ett exempel, låt oss se följande reaktioner:
2 H2 (gas) + O2 (gas) → 2 H2O (vätska); ΔH ° = -571,6 kJ (exoterm).
H2 (gas) + (½) O2 (gas) → H2O (vätska); ΔH ° = -285,8 kJ (exoterm).
2 H2O (vätska) → 2 H2 (gas) + O2 (gas); ΔH ° = +571,6 kJ (endotermisk).
Entalpi är en omfattande termodynamisk mängd
Om termerna för en kemisk ekvation multipliceras eller divideras med en viss faktor, multipliceras eller divas den entalpin med den.
Om reaktionen investeras investeras också tecknet på reaktionsenthalpin.
Löst övningar
-Övning 1
C2H2 -acetylengas erhålls från CAC2 -kalciumkarbidreaktionen som kommer på ett granulerat sätt med vatten vid miljö och miljötryck.
Som data finns det entalpier för reagensbildning:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
Och entalpin av produktbildning:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Hitta reaktionens standard entropi.
Lösning
Det första är att höja den balanserade kemiska ekvationen:
CAC2 (S) + 2H20 (L) → Ca (OH) 2 (S) + C2H2 (G)
Och nu Entalpierna från reagens, produkter och reaktionen:
- Reagens: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Produkter: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Det kan tjäna dig: vad är coplanares vektorer? (Med lösta övningar)- Reaktion: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Det är en exoterm reaktion.
-Övning 2
När 1 liter acetylen brinner i standardförhållanden, hur mycket värme lossnar den?
Lösning
Förbränningsreaktionen av acetylen en gång balanserad är så här:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (L)
Vi behöver entalpier för produktutbildning:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Beräkning av entalpier
Med dessa data kan vi beräkna produkternas entalpi:
ΔH ° (produkter) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
Och reagensbildningsentalpin:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Reagensens entalpi kommer att vara:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Den molära reaktionsentalpin kommer då att vara: ΔH ° (produkter) - ΔH ° (reagens) = -1072,8 kJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Förbränningsentalpi
Nu måste vi veta hur många mol acetylen som är en liter acetylen i standardförhållanden. För detta kommer vi att använda tillståndsekvationen för en idealisk gas, från vilken vi kommer att rensa antalet mullvader.
Antal mol n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ PA
V = 1 l = 1,0 x 10^-3 m³
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Entalpin för förbränning av 1 liter acetylen är 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Det negativa tecknet indikerar att det är en exoterm reaktion som avger 53,13 kJ = 12,69 kcal.
Referenser
- Castaños e. Entalpi i kemiska reaktioner. Återhämtat från: LidiaConlachimica.WordPress.com
- Termokemi. Reaktionsentalpi. Hämtad från: resurser.utbildning.är
- Termokemi. Definition av standardreaktionsentalpi. Återhämtat sig från: Quimitube.com
- Wikipedia. Standardreaktionsenthalpi. Återhämtat sig från: Wikipedia.com
- Wikipedia. Träningsparthy. Återhämtat sig från: Wikipedia.com

