Lewis struktur vad det består av, hur det görs, exempel

- 3176
- 330
- Johan Johansson
De Lewis -struktur Det är allt som representation av kovalenta bindningar inom en molekyl eller en jon. I den representeras dessa bindningar och elektroner med långa punkter eller skript, även om punkterna för det mesta motsvarar de inte delade elektronerna och skripten till de kovalenta bindningarna.
Men vad är en kovalent länk? Det är delningen av ett par elektroner (eller punkter) mellan två atomer i det periodiska bordet. Med dessa diagram kan du skissa många skelett för en viss förening. Vilken av dem är den rätta beror på de formella belastningarna och den kemiska naturen hos samma atomer.
 2-bromopropan förening. Av Ben Million [Public Domain], från Wikimedia Commons.
2-bromopropan förening. Av Ben Million [Public Domain], från Wikimedia Commons. I den överlägsna bilden finns ett exempel på vad en Lewis -struktur är. I detta fall är den representerade föreningen 2-bromopropano. De svarta punkterna som motsvarar elektronerna kan ses, både de som deltar i länkarna och de som inte delas (det enda vridmomentet precis ovanför BR).
Om punkterna punkter ":" ersattes av ett långt manus "-", skulle kol-skelettet i 2-bromopropanen representeras som: C-C-C-C. Varför istället för "molekylär ram" ritad, kan det vara C-H-C? Svaret ligger i de elektroniska egenskaperna hos varje atom.
Eftersom väte bara har en elektron och en enda omloppsplats tillgänglig för fyllning, är det således bara en kovalent bindning. Därför kan du aldrig bilda två bindningar (inte förvirra med vätebroar). Å andra sidan tillåter den elektroniska konfigurationen av kolatomen (och kräver) bildningen av fyra kovalenta bindningar.
Av den anledningen måste Lewis strukturer där C och H vara konsekvent och respektera vad som styrs av deras elektroniska konfigurationer. På detta sätt, om kol har mer än fyra bindningar, eller väte mer än en, kan skissen uteslutas och starta en ny till i linje med verkligheten.
Det är här som några av de främsta orsakerna eller ryggen i dessa strukturer dyker upp, introducerade av Gilbert Newton Lewis i deras sökning efter molekylrepresentationer trogen till experimentella data: molekylstrukturen och formella belastningar.
Alla befintliga föreningar kan representeras av Lewis -strukturer, vilket ger en första metod för hur molekylen eller jonerna kan vara.
[TOC]
Vad är Lewis struktur?
Det är en representativ struktur av Valencia -elektroner och kovalenta bindningar i en molekyl eller jon som tjänar till att ha en uppfattning om dess molekylstruktur.
Men denna struktur misslyckas med att förutsäga några viktiga detaljer såsom molekylgeometri med avseende på en atom och dess omgivningar (om den är fyrkantig, platt, bipiramidal, etc.).
Det säger också ingenting om vad som är den kemiska hybridiseringen av dess atomer, men där dubblarna eller trippelbindningarna placeras och om det finns resonans i strukturen.
Med denna information kan du argumentera om reaktiviteten hos en förening, dess stabilitet, hur och vilken mekanism molekylen kommer att följa när du reagerar.
Av denna anledning slutar Lewis strukturer aldrig övervägas och är mycket användbara, eftersom de kan kondensera nytt kemiskt lärande.
Hur är det gjort?
För att rita eller skissa en struktur, formel eller Lewis -diagram är den kemiska formeln för föreningen väsentlig. Utan det kan du inte ens veta vilka atomer som utgör det. En gång med det används den periodiska tabellen för att hitta vilka grupper som hör hemma.
Kan tjäna dig: Viskositet: Exempel, orsaker, enheter, typerOm du till exempel har sammansatt C14ANTINGEN2N3 Då måste vi leta efter grupperna där kol, syre och kväve är. Gjort detta, oavsett föreningen, är antalet valenselektroner fortfarande detsamma, så förr eller senare memorerar de.
Således tillhör kol momsgruppen, syre till via grupp och kväve till VA. Gruppnumret är lika med mängden elektroner (punkter) i Valencia. Alla har gemensamt tendensen att slutföra Octet i Valencia -lagret.
Vad är oktettregeln?
Detta säger att det finns en trend av atomer att slutföra sin energinivå med åtta elektroner för att uppnå stabilitet. Detta gäller alla icke -metalliska element eller de som finns i block S eller P i det periodiska tabellen.
Men inte alla element följer oktettregeln. Särskilda fall är övergångsmetaller, vars strukturer är mer baserade på formella belastningar och deras gruppnummer.
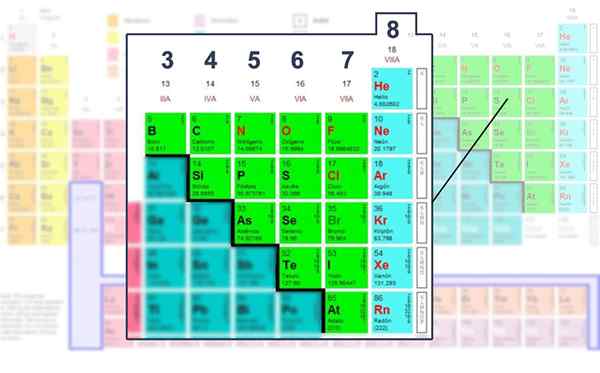 Antal elektroner i Valencia -skiktet i de icke -metalliska elementen, de där det kan drivas med Lewis -strukturen.
Antal elektroner i Valencia -skiktet i de icke -metalliska elementen, de där det kan drivas med Lewis -strukturen. Tillämpa den matematiska formeln
Genom att veta vilken grupp elementen tillhör, och därför antalet valenselektroner tillgängliga för att bilda länkar, görs följande formel, vilket är användbart för att rita Lewis strukturer:
C = n - d
Där C betyder delade elektroner, det vill säga de som deltar i de kovalenta bindningarna. Eftersom varje länk består av två elektroner är C/2 lika med antalet länkar (eller skript) som måste dras.
N är Nödvändiga elektroner, De som måste ha atomen i sitt Valencia -skikt för att vara isolektroniskt till den ädla gasen som följer under samma period. För alla andra element än H (eftersom det kräver två elektroner för att jämföra med han) behöver de åtta elektroner.
D är Tillgängliga elektroner, som bestäms av gruppen eller elektronerna i Valencia. Således, när CL tillhör grupp VIIA, måste den vara omgiven av sju svarta eller elektroner, och kom ihåg att ett par behövs för att bilda en länk.
Att ha atomerna, deras punkter och antalet länkar c/2, en Lewis -struktur kan sedan improviseras. Men dessutom är det nödvändigt att ha en uppfattning om andra "regler".
Var man ska placera de mindre elektronegativa atomerna
De mindre elektronegativa atomerna i de allra flesta strukturer upptar centra. Av denna anledning, om du har en förening med atomer av P, O och F, måste P därför vara i mitten av den hypotetiska strukturen.
Det är också viktigt att lyfta fram att hydrogener vanligtvis är kopplade till mycket elektronegativa atomer. Om du har i en Zn, H och O-förening kommer H att gå bredvid O och inte med Zn (Zn-O-H och No H-Zn-O). Det finns undantag från denna regel, men förekommer vanligtvis med icke -metalliska atomer.
Symmetri och formella belastningar
Naturen har en hög preferens för att orsaka molekylstrukturer så symmetriska som möjligt. Detta hjälper till att undvika att höja oordningliga strukturer, med atomerna arrangerade på ett sådant sätt att de inte följer något uppenbart mönster.
Det kan tjäna dig: Acid-Bass Theories: Arrhenius, Bronsted-Lowry, LewisTill exempel för förening C2TILL3, Där A är en fiktiv atom, skulle den mest troliga strukturen vara A-C-A-A-A. Notera symmetrin på deras sidor, båda reflektionerna av den andra.
Formella belastningar spelar också en viktig roll när man ritar Lewis strukturer, särskilt för joner. Således kan länkar läggas till eller tas bort så att den formella belastningen av en atom motsvarar den totala belastningen som visas. Detta kriterium är till stor hjälp för övergångsmetallföreningar.
Begränsningar i oktetregeln
 Aluminium Trifluoridrepresentation, en förening som är instabil. Båda elementen består av sex elektroner, som genererar tre kovalenta bindningar, när de ska vara åtta för att uppnå stabilitet. Källa: Gabriel Bolívar
Aluminium Trifluoridrepresentation, en förening som är instabil. Båda elementen består av sex elektroner, som genererar tre kovalenta bindningar, när de ska vara åtta för att uppnå stabilitet. Källa: Gabriel Bolívar Inte alla regler är uppfyllda, vilket inte nödvändigtvis betyder att strukturen är felaktig. Typiska exempel på detta observeras i många föreningar där element i grupp IIIA (B, AL, GA, IN, TL) är involverade. Här betraktas specifikt aluminium Trifluoruro (ALF3).
Sedan tillämpar du formeln som beskrivs ovan, har du:
D = 1 × 3 (en aluminiumatom) + 7 × 3 (tre fluoratomer) = 24 elektroner
Här på 3 och 7 är respektive grupper eller antal valenselektroner tillgängliga för aluminium och fluorid. Sedan med tanke på nödvändiga elektroner N:
N = 8 × 1 (en aluminiumatom) + 8 × 3 (tre fluoratomer) = 32 elektroner
Och därför är de delade elektronerna:
C = n - d
C = 32 - 24 = 8 elektroner
C/2 = 4 länkar
Eftersom aluminium är den minst elektronegativa atomen måste den placeras i mitten, och fluoren bildar bara en länk. Med tanke på detta har du Lewis del Alf -strukturen3 (övre bild). Delade elektroner markeras med gröna punkter för att skilja dem från de okomplicerade.
Även om beräkningarna förutsäger att det finns fyra länkar som måste bildas, saknar aluminium tillräckligt med elektroner och det finns inte heller någon fjärde fluoratom. Som ett resultat uppfyller aluminium inte Octet -regeln och detta faktum återspeglas inte i beräkningarna.
Lewis Structures Exempel
Jod
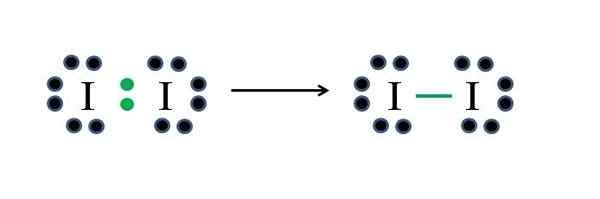 JODO icke -metaller har sju elektroner vardera, så genom att dela en av dessa elektroner vardera genererar de en kovalent bindning som ger dem stabilitet. Källa: Gabriel Bolívar
JODO icke -metaller har sju elektroner vardera, så genom att dela en av dessa elektroner vardera genererar de en kovalent bindning som ger dem stabilitet. Källa: Gabriel Bolívar Jod är en halogen och tillhör därför grupp VIIA. Den har sedan sju elektroner av Valencia, och denna enkla diatomiska molekyl kan representeras improvisera eller tillämpa formeln:
D = 2 × 7 (två jodatomer) = 14 elektroner
N = 2 × 8 = 16 elektroner
C = 16 - 14 = 2 elektroner
C/2 = 1 länk
Eftersom 14 elektroner 2 deltar i den kovalenta bindningen (gröna punkter och skript) förblir 12 som inte delade; Och eftersom de är två jodatomer måste 6 distribueras för en av dem (deras valenselektroner). I denna molekyl är endast denna struktur möjlig, vars geometri är linjär.
Ammoniak
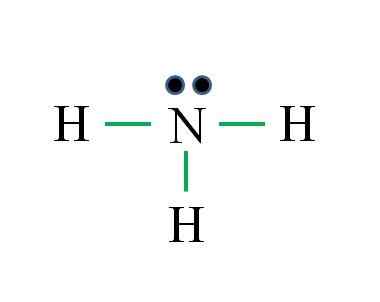 Kväve har 5 elektroner, medan väte endast 1. Tillräckligt för att uppnå stabilitet när tre kovalenta bindningar upprättas, bestående av en elektron av N och en annan av H -källa: Gabriel Bolívar
Kväve har 5 elektroner, medan väte endast 1. Tillräckligt för att uppnå stabilitet när tre kovalenta bindningar upprättas, bestående av en elektron av N och en annan av H -källa: Gabriel Bolívar Vad är Lewis struktur för ammoniakmolekyl? Eftersom kväve kommer från VA -gruppen har det fem elektroner i Valencia, och sedan:
Det kan tjäna dig: Laboratorietermometer: Egenskaper, vad är det för, användning, exempelD = 1 × 5 (en kväveatom) + 1 × 3 (tre väteatomer) = 8 elektroner
N = 8 × 1 + 2 × 3 = 14 elektroner
C = 14 - 8 = 6 elektroner
C/2 = 3 länkar
Den här gången är formeln rätt med antalet länkar (tre gröna länkar). Från de 8 tillgängliga elektronerna 6 deltar i bindningarna finns det ett icke -delat vridmoment som ligger ovanför kväveatomen.
Denna struktur säger allt som borde vara känt från ammoniakbasen. Genom att tillämpa kunskapen om TEV och TRPEV följer det att geometri är tetraedral förvrängd av det fria kväve -vridmomentet och att hybridiseringen av detta därför är SP3.
C2H6ANTINGEN
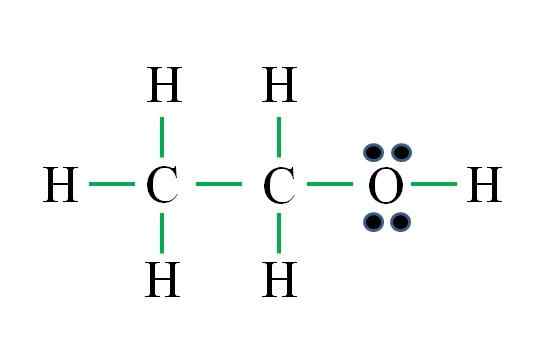 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Formeln motsvarar en organisk förening. Innan man använder formeln bör det komma ihåg att hydrogener bildar en enda bindning, syre två, kol fyra och att strukturen måste vara så symmetrisk som möjligt. Fortsätter som de tidigare exemplen är:
D = 6 × 1 (sex väteatomer) + 6 × 1 (en syreatom) + 4 × 2 (två kolatomer) = 20 elektroner
N = 6 × 2 (sex väteatomer) + 8 × 1 (en syreatom) + 8 × 2 (två kolatomer) = 36 elektroner
C = 36 - 20 = 16 elektroner
C/2 = 8 länkar
Antalet gröna skript motsvarar de 8 beräknade länkarna. Den föreslagna Lewis -strukturen är den för etanol Ch3Ch2Åh. Det hade emellertid också varit korrekt att föreslå strukturen för dimetyletern3Ägg3, vilket är ännu mer symmetriskt.
Vilken av de två är "mer" korrekt? Båda är lika, eftersom strukturerna uppstod som strukturella isomerer av samma molekylformel C2H6ANTINGEN.
Permanganatjon
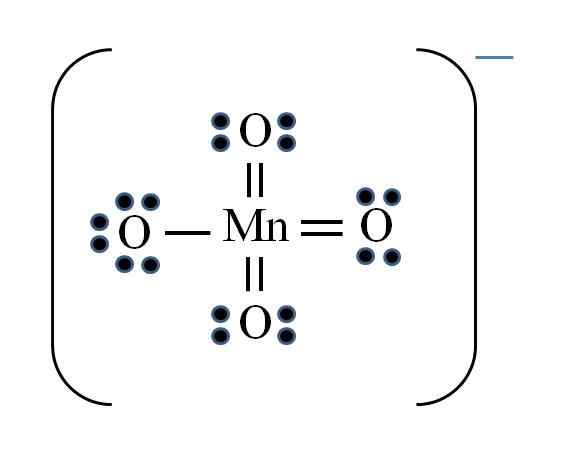 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Situationen är komplicerad när du vill göra Lewis -strukturer för övergångsmetallföreningar. Mangan tillhör viib -gruppen, även elektronen för den negativa belastningen måste läggas till bland de tillgängliga elektronerna. Tillämpa den formel du har:
D = 7 × 1 (en manganatom) + 6 × 4 (fyra syreatomer) + 1 elektron per belastning = 32 elektroner
N = 8 × 1 + 8 × 4 = 40 elektroner
C = 40 - 32 = 8 delade elektroner
C/2 = 4 länkar
Övergångsmetaller kan dock ha mer än åtta elektroner i Valencia. Också för mnojonen4- Visar den negativa belastningen, det är nödvändigt att minska de formella belastningarna av syreatomer. Som? Genom de dubbla länkarna.
Om alla MNO: s länkar4- De var enkla, de formella belastningarna av syre skulle vara lika med -1. Eftersom det finns fyra skulle den resulterande belastningen vara -4 för anjon, vilket uppenbarligen inte är sant. När dubbelbindningarna bildas är det garanterat att ett enda syre har en negativ formell belastning, återspeglas i jonen.
I permanganatjonen kan man se att det finns resonans. Detta innebär att den enda enkla MN-O-länken demokaliseras mellan de fyra atomerna i O.
Dikromatjon
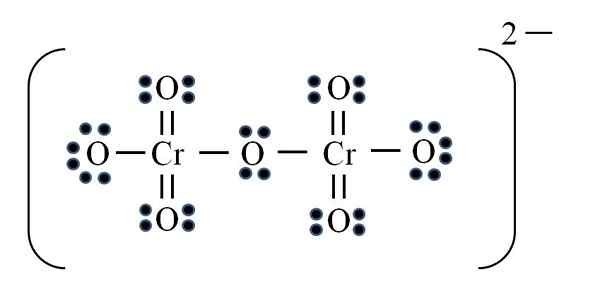 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Slutligen inträffar ett liknande fall med Dicromato -jonen (Cr2ANTINGEN7). Kromet tillhör Vib -gruppen, så den har sex elektroner i Valencia. Tillämpa formeln igen:
D = 6 × 2 (två kromatomer) + 6 × 7 (sju syreatomer) + 2 elektroner med den tvåvärda belastningen = 56 elektroner
N = 8 × 2 + 8 × 7 = 72 elektroner
C = 72 - 56 = 16 delade elektroner
C/2 = 8 länkar
Men det finns inga 8 länkar, men 12. Av samma skäl som hittades, måste två syre i permanganatjonen vara kvar med negativa formella belastningar som tillför -2, belastningen på dikromatojonen.
Så många dubbla länkar läggs till vid behov. På detta sätt når du Lewis -strukturen för bilden för CR2ANTINGEN72-.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan.). Cengage Learning, s 251.
- Lewis -strukturer. Taget från: kemed.Kem.Purdu.Edu
- Steven a. Hardinger, Institutionen för kemi och biokemi, UCLA. (2017). Lewis -struktur. Taget från: Chem.Ucla.Edu
- Wayne Breslyn. (2012). Ritning av Lewis -strukturer. Taget från: terpconnect.Umd.Edu
- Webblomare. (2012). Lewis ("elektron dot") strukturer. Institutionen för kemi, University of Maine, Orono. Taget från: kemi.Umeche.Maine.Edu
- Lancaster, Sean. (25 april 2017). Hur man bestämmer hur många prickar som finns på ett elements Lewis Dot -struktur. Forskning. Återhämtat sig från: forskning.com
- « Privata administrationsegenskaper och exempel
- Lärande teorier huvudsakliga egenskaper och författare »

