Tertiärstrukturen för de viktigaste egenskaperna
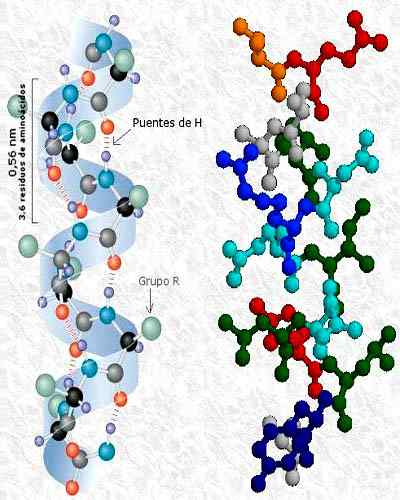
- 2150
- 382
- PhD. Lennart Johansson
De Tertiär struktur av proteiner Det är den tre dimensionella konformationen som polypeptidkedjor förvärvar när de viks på sig själva. Denna konformation visas genom interaktioner mellan sidokedjorna i aminosyravfallet från polypeptiden. Sidokedjor kan interagera oberoende av sin position i proteinet.
Eftersom det beror på interaktioner mellan R -grupper, visar den tertiära strukturen icke -repetitiva aspekter av kedjan, eftersom dessa grupper är olika för varje aminosyrarester. Sekundär struktur beror å andra sidan karboxyl- och aminogrupper, som finns i alla aminosyror.
 Tertiär struktur av kinasfosfatasproteinet, med sekundära strukturer i alfa- och betablad. Tagen och redigerad från: A2-33. Modifierad av Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Tertiär struktur av kinasfosfatasproteinet, med sekundära strukturer i alfa- och betablad. Tagen och redigerad från: A2-33. Modifierad av Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Vissa författare föreslår att fibrösa proteiner har en enkel tertiär struktur, men ändå påpekar andra författare att denna struktur är typisk för globulära proteiner.
[TOC]
Fibrösa proteiner
I fibrösa proteiner är polypeptidkedjor ordnade i form av långa filament eller långa ark; De består vanligtvis av en unik typ av sekundär struktur. Denna sekundära struktur är i de flesta fall viktigare än den tertiära strukturen vid bestämning av proteinform.
Dess biologiska funktion är strukturell, ger styrka och/eller elasticitet till organen och strukturerna där de finns, samtidigt som de håller dem ihop. Alla fibrösa proteiner är olösliga i vatten på grund av den stora mängden hydrofoba aminosyror som de presenterar.
Bland dessa fibrösa proteiner är keratiner och kollagen. De förstnämnda finns i konjunktiva tyger och i strukturer som hårstrån, naglar (a-queratinas), skalor och fjädrar (ß-cheatins). Kollagen finns under tiden i ben, senor och hud, bland andra.
α-queratinas
Dessa proteiner är en del av de så kallade mellanliggande filamentproteinerna, som spelar en viktig roll i cytoskeletten hos multicellulära organismer. Dessutom är de den viktigaste beståndsdelen av hår, naglar, ull, horn, hovar och ett av huvuddjurens hudproteiner.
Kan tjäna dig: Kinyoun -färgningMolekylens struktur är en α -propell. Två trådar av a-queratin kan ordnas parallellt och registrera varandra med deras r hydrofoba grupper som interagerar mellan dem. På detta sätt skapas en superhelisk eller kulstruktur med lindning till vänster.
Den tertiära strukturen för a keratin är enkel och domineras av den sekundära strukturen i a-helix. Å andra sidan är den kvartära strukturen också närvarande, eftersom två molekyler deltar i den superhelikoidala strukturen, som interagerar genom icke -kovalenta bindningar.
p-queratinas
Den primära strukturen liknar den för a-queratinas, men dess sekundära struktur domineras av ß-ark. De är den huvudsakliga beståndsdelen i skalorna i reptilerna och fåglarnas fjädrar.
Kollagen
Detta protein kan representera mer än 30% av den totala proteinmassan hos vissa djur. Det finns i Cartilagos, ben, senor, hornhinnor och hud, bland andra vävnader.
Kollagenens sekundära struktur är unik och representeras av en Levogira -propell med 3,3 aminosyravfall för varje varv. Tre Levogyous propellerkedjor (α).
Tropokollagenmolekyler samlas för att bilda en kollagenfiber som har stort motstånd, högre än stål och jämförbart med koppar med hög resistens.
Andra fibrösa proteiner
Andra typer av fibrösa proteiner är fibroin och elastin. Den första av dem bildas av ß -ark, främst utgörs av glycina, alanin och serin.
De laterala kedjorna för dessa aminosyror är små, så att de kan förpackas nära. Resultatet är en fiber som är både mycket motståndskraftig och mycket oöverträffad.
Kan tjäna dig: fosfatbuffert (PBS): Foundation, förberedelse och användningI elastinet ersätter valinen serinen bland dess huvudsakliga beståndsdelar aminosyror. Till skillnad från fibroin är Elastin mycket utdragbar, därmed namnet. I molekylens konstitution verkar också lysin, som kan delta i tvärbindning som gör att Elastin kan återvinna sin form när spänningen upphör.
Kulaproteiner
Globularproteiner, till skillnad från fibrösa, är lösliga och har i allmänhet flera typer av sekundära strukturer. I detta är emellertid viktigare tre -dimensionella konformationer som de förvärvar när de viks på sig själva (tertiär struktur).
Dessa speciella tre -dimensionella konformationer ger specifik biologisk aktivitet för varje protein. Huvudfunktionen för dessa proteiner är reglerande, som med enzymer.
Egenskaper för den tertiära strukturen hos kulaproteiner
Den tertiära strukturen för kulapartiser har några viktiga egenskaper:
- Globularproteiner är kompakta tack vare förpackningar när polypeptidkedjan veck.
- Det avlägsna aminosyravfallet i den primära strukturen hos polypeptidkedjor är nära, att kunna interagera med varandra på grund av vikningen.
- Större globulära proteiner (mer än 200 aminosyror) kan ha flera kompakta segment, oberoende mellan dem och med särskilda funktioner, och var och en av dessa segment kallas domän. En domän kan ha mellan 50 och 350 aminosyravfall.
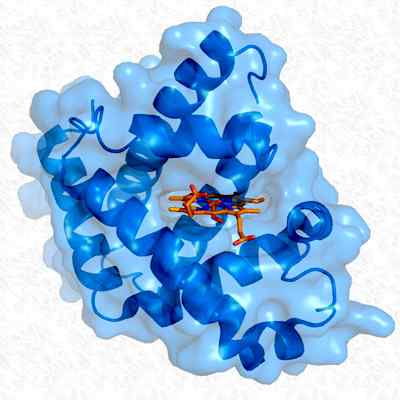 Tertiärstruktur av myoglobin. Tagen och redigerad från: Thomas SplettStoesser. Modifierad av Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Tertiärstruktur av myoglobin. Tagen och redigerad från: Thomas SplettStoesser. Modifierad av Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Allmänna regler för vikningen av globala proteiner
Som redan nämnts har proteiner särskilda vikningsformer, vilket ger dem också särskilda egenskaper. Denna vikning är inte slumpmässig och gynnas både av den primära och sekundära strukturen och av vissa icke -kovalenta interaktioner, och det finns också några fysiska begränsningar för vikningen, så vissa regler har formulerats:
Kan tjäna dig: primära lymfoida organ- Alla globulära proteiner har definierat distributionsmönster, med hydrofoba grupper riktade in i molekylen och hydrofil avfall i det yttre skiktet i det yttre lagret. För detta krävs minst två lager av sekundär struktur. Ss-a-p-slingan och a-a-toppen kan bidra med dessa två lager.
- Ss -ark är vanligtvis ordnade i en levogira rullad form.
- I en polypeptidkedja kan olika svängar inträffa för att röra sig från en sekundär till en annan struktur, såsom ß eller y -varv, som kan kunna investera kedjans riktning i fyra aminosyravfall eller mindre.
- Globulära proteiner har a, ß -ark, oregelbundet strukturerade vändningar och segment.
Protein denaturering
Om ett protein förlorar sin ursprungliga (naturliga) tre -dimensionella struktur, förlorar den sin biologiska aktivitet och de flesta av dess specifika egenskaper. Denna process kallas denaturering.
Denaturering kan uppstå när naturliga miljöförhållanden förändras, till exempel genom varierande temperatur eller pH. Processen är irreversibel i många proteiner; Andra kan emellertid spontant återvinna sin naturliga struktur genom att återställa normala miljöförhållanden.
Referenser
- C.K. Mathews, K.OCH. Van Hold & K.G. Ahern (2002). Biokameri. Tredje upplagan. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, s. Mayes, D.C. Granner & V.W. Rodwell (1996). Harpers biokameri. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biokameri. Femte upplagan. W. H. Frigöring.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) Cells värld. Sjätte upplagan. Pearson Education Inc.
- TILL.Lehninger (1978). Biokemi. Omega -utgåvor, s.TILL.
- T. McKee & J.R. McKee (2003). Biokemi: livets molekylära grund. 3: e upplagan. McGraw-HIII Companies, Inc.
- « Fermioniska kondensategenskaper, applikationer och exempel
- Dodecil natriumsulfat (SDS) struktur, egenskaper, användningar »

