Tumörnekrosfaktor (TNF) struktur, verkningsmekanism, funktion
- 4359
- 1318
- Erik Eriksson
han Tumörnekrosfaktor (TNF), även känd som Caquectin, är ett naturligt producerat protein i fagocytiska eller makrofagceller i människokroppen och andra däggdjursdjur. Det är en mycket viktig cytkvin som deltar i både normala fysiologiska processer och i mångfalden av kroppspatologiska processer.
Hans upptäckt är från drygt 100 år sedan, när W. Coley använde råa bakterieekstrakt för att behandla tumörer hos olika patienter och fann att dessa extrakt hade förmågan att inducera nekrosen hos dessa tumörer, medan de utlöste en systemisk inflammatorisk reaktion hos patienter hos patienter.
 Tumörnekros Alpha Mouse Factor (Källa: TK Vallery/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons)
Tumörnekros Alpha Mouse Factor (Källa: TK Vallery/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons) Den huvudsakliga "pro-inflammatoriska" stimulatorn som aktiverades av de bakteriella extrakten som användes av Coley identifierades 1975, vilket visade att en proteinfaktor i serumet hos behandlade patienter orsakade tumörlys, där namnet som identifierar denna grupp av denna grupp uppstod proteiner (TNF -a).
Cirka 10 år senare, 1984, isolerades och renades "tumörnekrosfaktor" -genen, och av samma datum isolerades och renades ett annat liknande protein i T -lymfocyterna, som kallades "T alfa T -lymfotoxin" (TLa), som därefter var känd som en TNF-p-faktor.
För närvarande har många proteiner som liknar TNF som ursprungligen beskrivits definierats, vilket utgör TNF-proteinfamiljen (tumörnekrosfaktortyp) och inklusive TNF-a, TNF-p-proteiner, CD40-liganden (CD40L), ligand FAS ( Fasl) och många andra.
[TOC]
Strukturera
På gennivå
Den kodande genen för TNF-a-proteinet finns i kromosom 6 (kromosom 17 i gnagare) och den som kodar för TNF-p-proteinet föregår det föregående i båda fallen (mänskliga och gnagare). Dessa två gener är i en enda kopia och har en ungefärlig storlek på 3 kb.
Med tanke på det faktum att sekvensen som motsvarar den främjande regionen för TNF-a-genen har flera fackliga platser för en transkriptionsfaktor som kallas ”Kappa B-kärnfaktor” (NF-KB) anser många författare att deras uttryck beror på denna faktor.
Promotorns region av TNF-p-genen har å andra sidan en sekvens av förening för ett annat protein som kallas "High Mobility Group 1" (HMG-1, från engelska Grupp med hög mobilitet 1).
Kan tjäna dig: myosin: egenskaper, struktur, typer och funktionPå proteinnivån
Två former av Alfa-tumörnekrosfaktorn har beskrivits, en som är kopplad till membranet (MTNF-a) och en annan som alltid är löslig (STNF-a). Beta-tumörnekrosfaktor finns å andra sidan endast i en löslig form (STNF-p).
Hos människor består TNF-a-membranformen av en polypeptid av drygt 150 aminosyravfall, som är fästa vid en "ledare" -sekvens med 76 ytterligare aminosyror. Den har en uppenbar molekylvikt på cirka 26 kDa.
Omlokaliseringen av detta protein till membranet inträffar under dess syntes och denna form "omvandlas" till den lösliga formen (17 kDa) av ett enzym som kallas "konverterande enzymet av TNF-a", som kan omvandla MTNF-a till STNF -a.
Handlingsmekanism
Proteiner som tillhör tumörnekrosfaktorgruppen (TNF) utövar sina funktioner främst tack vare deras associering med specifika receptorer i mänskliga kroppsceller och andra djur.
Det finns två typer av receptorer för TNF-proteiner i plasmamembran av mycket av kroppsceller, med undantag för erytrocyter: typ I-receptorer (TNFR-55) och typ II-receptorer (TNFR-75).
Båda typerna av receptorer delar en strukturell homologi med avseende på den extracellulära unionens plats för TNF -proteiner och binder också till dessa med motsvarande affinitet. De skiljer sig sedan i de intracellulära signalvägarna som aktiveras när processen för ligand-mottagare har inträffat.
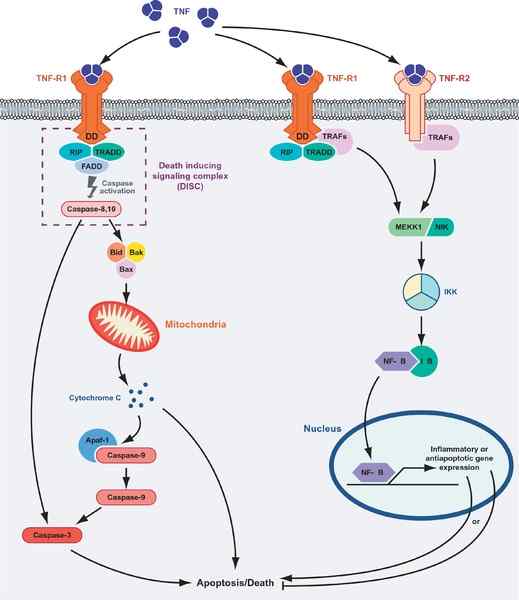 Celldöd eller överlevnad medierad av TNF -proteiner. Till vänster om grafiken visas den apoptotiska rutten och "överlevnad" -vägen (källa: Masmudur M. Rahman, Grant McFadden/CC av (https: // CreativeCommons.Org/licenser/av/1.0) via Wikimedia Commons)
Celldöd eller överlevnad medierad av TNF -proteiner. Till vänster om grafiken visas den apoptotiska rutten och "överlevnad" -vägen (källa: Masmudur M. Rahman, Grant McFadden/CC av (https: // CreativeCommons.Org/licenser/av/1.0) via Wikimedia Commons) Ligand-receptorinteraktionen mellan TNF med någon av dess receptorer främjar föreningen mellan tre receptorer till en löslig trimer av TNF-a (trimerisering av receptorerna), och nämnda interaktion utlöser cellulära svar även när endast 10% av receptorerna är ockuperade.
Union i typ I -receptorer
Ligand-receptorförbundet med typ I-receptorer fungerar som en "rekryteringsplattform" för andra signalproteiner i cytosoliska domäner hos receptorerna (den interna delen). Bland dessa proteiner är den första som "få" Tradd eller proteinproteinet med dödsdomän associerad med TNFR-1-receptorn (engelska TNFR-1-associerat dödsdomänprotein).
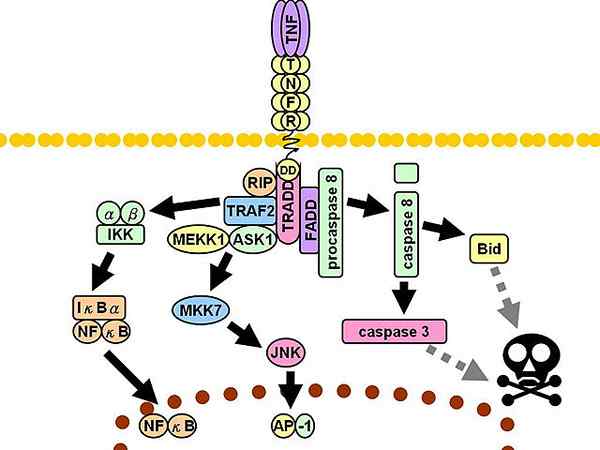 TNFR1 -signalväg. Diskontinuerliga grå linjer representerar flera steg.
TNFR1 -signalväg. Diskontinuerliga grå linjer representerar flera steg. Därefter rekryteras ytterligare tre mediatorer: interaktionsprotein med mottagare 1 (RIP1, från engelska Mottagarintresseringsprotein 1), Protein med dödsdomän associerad med FAS (FADD, engelska FAS-associerat dödsdomänprotein) och faktor 2 associerad med TNF -mottagaren (TRAF2, engelska TNF-receptorassocierad faktor 2).
Kan tjäna dig: fenylalanin: egenskaper, funktioner, biosyntes, matTyp II -receptorer
När TNF binder till typ II -receptorer resulterar detta i direkt rekrytering av TRAF2 -proteinet, som i sin tur rekryterar TRAF1 -proteinet. Dessa proteiner aktiverar MAPK -proteinvägarna (från engelska Mytogenaktiverat proteinkinas), mycket viktigt från den intracellulära signaleringssynpunkten i eukaryoter.
Många av signalvägarna som aktiveras efter föreningen av TNF -faktorer till deras receptorer är också relaterade till aktiveringen av specifika transkriptionsfaktorer, som utlöser gemensamma svar som har beskrivits som biologiska "effekter" av TNF -proteiner.
Fungera
TNF-a-protein produceras huvudsakligen av makrofager i immunsystemet, medan TNF-p-protein produceras av T-lymfocyter. Det har emellertid visats att andra kroppsceller också producerar dessa faktorer, men i mindre utsträckning.
Tumornekrosfaktorn har studerats mycket för dess implikationer i normala fysiologiska processer, liksom i akuta och kroniska inflammatoriska patologiska processer, i autoimmuna sjukdomar och i inflammatoriska processer relaterade till olika typer av cancer.
Dessa proteiner är kopplade till snabb viktminskning hos patienter som lider av akuta bakterieinfektioner, som lider av cancer och som passerar genom en septisk "kollision".
Tre olika biologiska aktiviteter har beskrivits för tumörnekrosfaktor:
- cytotoxicitet mot tumörceller
- undertryckning av lipoproteinlipas av adipocyter (LPL) och
- Minskning av vilopotentialen för myocytermembranet (muskelceller).
TNF-a-membranformen främjar cytotoxicitet och har varit involverad i Paracrinaktiviteterna i TNF i vissa vävnader.
När en stimulans som ett bakteriellt endotoxin uppfattas, är denna form Proteolypro Active TNF i serum och andra kroppsvätskor.
Kan tjäna dig: enzym: operation och exempelBland dess biologiska funktioner kan TNF -proteiner också bidra till lymfocyt- och leukocytaktivering och migration, samt främja cellproliferation, differentiering och apoptos.
Hämmare
Många behandlande läkare recept TNF-proteinhämmare till patienter med autoimmuna sjukdomar (anti-TNF-terapi). Bland dessa ämnen är: infliximab, etanercept, adalimumab, golimumab och certolizumab pegol.
Den vanligaste användningsformen är genom subkutana injektioner i låren eller buken, och till och med direkt venös infusion utövas. Trots hur mycket av dessa ämnen kan hjälpa vissa patienter, finns det vissa negativa effekter förknippade med deras användning, bland vilka är en ökning av risken för att drabbas av infektioner som tuberkulos eller andra svampinfektioner.
"Naturliga" icke -farmakologiska hämmare
Några "klippta" fragment av TNF (typ I och typ II) -proteiner har också känt som TNF-unionsproteiner (TNF-BPS, engelska Bindande proteiner faktor nekro tumör) har upptäckts i urinen hos patienter med cancer, AIDS eller sepsis.
I vissa fall hämmar eller neutraliserar dessa fragment aktiviteten hos TNF-proteiner, eftersom de undviker ligandreceptorinteraktion.
Andra "naturliga" hämmare av TNF -proteiner har upptäckts i vissa växtprodukter härrörande från gurkmeja och granat, även om studier fortfarande genomförs i detta avseende.
Referenser
- Baud, v., & Karin, m. (2001). Signaltransduktion med tumörnekrosfaktor och dess släktingar. Trender i cellbiologi, 11 (9), 372-377.
- Chu, w. M. (2013). Faktornekrostumör. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, l. B. (2016). TNF -biologi, patogena mekanismer och nya terapeutiska strategier. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, eller., & Bałkowiec -iskra, och. (2014). Nekros tumörhämmare-tillstånd-kunskapsfaktor. Archives of Medical Science: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, pH. Ger. (1994). Nekros tumörfaktor: en pleiototropisk cytokin och terapeutiskt mål. Årlig översyn av medicin, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Struktur och funktion av tumörnekrosfaktor (TNF) vid cellytan. I Handbook of Cell Signaling (pp. 265-275). Akademisk press.
- « Kaliumfosfat (K3PO4) Struktur, egenskaper, användningar
- Vad är teorin om historia eller historiologi? »

