Kaliumfosfat (K3PO4) Struktur, egenskaper, användningar

- 2938
- 364
- Johan Gustafsson
han Kaliumfosfat Det är en oorganisk förening bildad av tre joner kalium k+ och en fosfatjon PO43-. Dess kemiska formel är k3Po4. Det är en färglös fast eller kristallin vit. Det är mycket lösligt i vatten och bildar alkaliska lösningar, det vill säga med många OH -joner-, Därför grundläggande pH.
Fosfatjonen har en viktig funktion i celler som har att göra med energilagring. Kaliumfosfat används ofta i organiska kemi -reaktioner där det kan fungera som bas, det vill säga att ta protoner H+. Det kan också fungera som en katalysator eller accelerator för vissa reaktioner.
 Kaliumfosfat k3Po4 fast. Xavier13540 på Chinese Wikipedia [Public Domain]. Källa: Wikimedia Commons.
Kaliumfosfat k3Po4 fast. Xavier13540 på Chinese Wikipedia [Public Domain]. Källa: Wikimedia Commons. Det har använts för att minska attacken av vissa insekter i vete växter eftersom det gör dem mer motståndskraftiga mot dessa. Det har emellertid observerats att det gynnar frigöringen av metan (Ch4), En växthusgas, rismikrokulturer.
Det har använts som ett laxermedel, för att öka varaktigheten för en lokalbedövning, för att stoppa karies och för att hjälpa till att täcka ytor, bland andra applikationer.
[TOC]
Strukturera
Kaliumfosfat består av tre katjoner kalium k+ och en fosfatanjon PO43-.
Fosfatjon PO43- Det bildas av en fosfor (P) atom och fyra syre (O) atomer, där fosfor har ett oxidationstillstånd på +5 och syre A -valens på -2 -2.
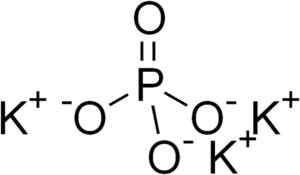 Kaliumfosfatstruktur k3Po4. EDGAR181 [Public Domain]. Källa: Wikimedia Commons.
Kaliumfosfatstruktur k3Po4. EDGAR181 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
- Kaliumfosfat
- Tripotasiumfosfat
- Kaliumstribasfosfat
- Tripotasium ortofosfat
Egenskaper
Fysiskt tillstånd
Färglöst fast eller kristallint vitt.
Molekylvikt
212,27 g/mol
Smältpunkt
1340 ºC
Densitet
2,564 g/cm3
Löslighet
Mycket lösligt i vatten: 106 g/100 g vatten vid 25 ° C. Olöslig i etanol.
pH
En lösning med 1% k3Po4 Den har ett pH på 11,5-12,3.
Kemiska egenskaper
Genom att upplösas i vatten separeras kaliumfosfat i de tre katjonerna Kalium K+ och fosfatanjonen PO43-. Fosfatanjonen tar en proton av vatten och HPO -vätofosfatjonen bildas42-. Den senare tar i sin tur en annan proton av vatten och blir dihydrogenofosfat h anjon2Po4-.
Kan tjäna dig: hur syntetiseras ett elastiskt material?Po43- + H2Eller ⇔ hpo42- + Åh-
Hpo42- + H2Eller ⇔ h2Po4- + Åh-
När formjoner åh- Den vattenhaltiga lösningen blir alkalisk.
Andra egenskaper
Förutom den vattenfria formen (utan vatten) har den flera hydratiserade former; Detta betyder att K -molekylen3Po4 Det kan åtföljas av en eller flera vattenmolekyler inom den kristallina strukturen.
Av denna anledning kan du till exempel bilda K monohydrat3Po4.H2Eller3Po4.3 timmar2Eller, stege och icke -dehydrat.
Fosfatfunktion i den mänskliga organmen
Fosfatjon PO43- Det är den vanligaste anjonen inuti cellerna och utövar en viktig funktion i energilagring.
Fosfatjonen deltar också i bildning och näringsaktiviteter av ben och tänder, eftersom det reglerar koncentrationen av kalcium på blodserum och i många energiöverföringsreaktioner i cellen.
Erhållande
Kaliumfosfat kan erhållas från reaktionen mellan KCl kaliumklorid och ammoniumfosfat (NH4)3Po4.
Kaliumklorid + ammoniumfosfat → kaliumfosfat + ammoniumklorid
3 kcl + (NH4)3Po4 → K3Po4 + 3 NH4Kli
Ansökningar
Som grund i organiska kemi -reaktioner
Kaliumfosfat k3Po4 Det har använts i flera organiska kemi -reaktioner. Till exempel tjänar det i syntesen av acetylen baserade på dibromerade föreningar.
I denna syntes inträffar en dehydrobromation (eliminering av väte och brom), där K3Po4 Ashidro fast (utan vatten) fungerar som en mjuk bas och tar två protoner från molekylen, de två bromatomerna elimineras och motsvarande acetylen erhålls.
C6H5-Chbr-ch2Br + 2 k3Po4 → C6H5-C≡CH + 2 KBR + 2 K2Hpo4
 Författare: Clker-fri-vektorbilder. Källa: Pixabay.
Författare: Clker-fri-vektorbilder. Källa: Pixabay. Som katalysator
K: t3Po4 Det fungerar som en katalysator i olika organiska kemi -reaktioner. Till exempel har det använts som ett fast ämne för att få biodiesel från begagnad stekolja.
Biodiesel är ett bränsle som liknar diesel men erhålls från fetter eller naturliga oljor som används eller inte.
Kan tjäna dig: Coulombimetry: Fundamentals, Types, ApplicationsKaliumfosfat var mer effektivt som katalysator eller accelerator för nämnda reaktion än natriumfosfat3Po4 och Cao kalciumoxid.
I jordbruket
K: t3Po4 Det har använts för att behandla veteväxter och göra dem motståndskraftiga mot vissa skadedjur.
 Vete växter kan behandlas med k3Po4 att vara resistent mot vissa typer av insekter. Författare: Hans Braxmeier. Källa: Pixabay.
Vete växter kan behandlas med k3Po4 att vara resistent mot vissa typer av insekter. Författare: Hans Braxmeier. Källa: Pixabay. Vissa forskare försökte veteplantor med kaliumfosfat och visade sig att detta resistens mot bladlöss Duraphis noxia, Ett insekt som attackerar dessa växter.
Efter applicering av en utspädd lösning av k3Po4 På plantorna var det mindre svårighetsgrad av symtomen som orsakades av dessa insekter och minskat antal bladlöss som matade på dessa.
 Författare: Hans Braxmeier. Källa: Pixabay.
Författare: Hans Braxmeier. Källa: Pixabay. I medicinska tillämpningar
Kaliumfosfat har använts för att modifiera bedövningseffekten av lidokain, en lokalbedövning. En lokalbedövning är ett läkemedel som när det appliceras i ett område i kroppen ger förlust av smärtkänslighet i det området.
Det konstaterades att k3Po4 Det gör det möjligt att förlänga lidokainens lokalbedövning.
Som laxerande
Kaliumfosfat ökar fluiditeten i tarminnehållet eftersom det hjälper till att behålla vatten i tarmen, vilket indirekt inducerar tarmmuskelkontraktion.
I veterinärmedicin
K: t3Po4 Det används hos djur med diabetisk ketoacidos (en komplikation av diabetes) för att behandla hypofospati (liten mängd fosfat i blodet).
Men när det levereras i överflöd kan det orsaka hypokalcemi (lite kalcium i blodet), hyperfospathia (överskott av fosfat i blodet), ofrivillig sammandragning av musklerna, mineralisering av mjuka vävnader och njursvikt.
 Hundar med diabetiker kan behandlas med kaliumfosfat. Författare: David Mark. Källa: Pixabay.
Hundar med diabetiker kan behandlas med kaliumfosfat. Författare: David Mark. Källa: Pixabay. För att erhålla DNA
Kaliumfosfat har använts som en buffert för att rena DNA i genetiklaboratorier.
DNA är ett protein som finns i celler och innehåller all den genetiska information som krävs för utveckling och funktion av levande varelser.
Det kan tjäna dig: fraktionerad destillation: process, utrustning, applikationer, exempelGenom att isolera DNA fördjupar forskare i studien av hur ärftliga karaktärer överförs, så kaliumfosfat är mycket användbart.
 Ritning av DNA -molekyl. Författare: Public DomainPartures. Källa: Pixabay.
Ritning av DNA -molekyl. Författare: Public DomainPartures. Källa: Pixabay. I flera applikationer
Kaliumfosfat k3Po4 det tjänar:
- Som ett kosttillskott,
- för elektrolytbyte,
- Som buffert, det vill säga som ett kemiskt system som gör det möjligt att kontrollera OH -jonnivåer- eller väte h+ I vattenlösning,
- Att stoppa eller hämma bildandet av tandkärna,
- som korrosionsinhibitor och anti -SNIFF -medel,
- Som agent för att behandla ytor och beläggningsmedel,
- Som frostskydd,
- i rengöringsprodukter.
 Korroderade rör. K: t3Po4 gör det möjligt att undvika korrosion i rören i vissa branscher eller processer. Författare: Michael Gaida. Källa: Pixabay.
Korroderade rör. K: t3Po4 gör det möjligt att undvika korrosion i rören i vissa branscher eller processer. Författare: Michael Gaida. Källa: Pixabay. Negativ aspekt för användning i jordbruket
Vissa forskare fann att genom att lägga till K3Po4 En metanemission ökas till en rismikrokultur (välj4) till atmosfären. Metan är en gas som bidrar till växthuseffekten och ökningen av temperaturen på vår planet.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kaliumfosfat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Panciera, d.L. (2012). Vätsketerapi vid endokrina och metaboliska störningar. Fosfortillskott. I vätska, elektrolyt- och syrabasstörningar i små djurpraxis (fjärde upplagan). Återhämtat sig från Scientedirect.com.
- Shenawi-Khalil, s. et al. (2012). Syntes av acetylener via dehydrobromation med användning av fast vattenfri kaliumfosfat som bas under fasöverföringstillstånd. Tetrahedronbrev, volym 53, nummer 18, 2012, sidorna 2295-2297. Återhämtat sig från Scientedirect.com.
- Guan, g. et al. (2009). Tri-passiumfosfat som en fast katalysator för biodieselproduktion från spillolja. Bränslebearbetningsteknik, volym 90, nummer 4, 2009, sidorna 520-524. Återhämtat sig från Scientedirect.com.
- Kulkami, m.TILL. (2012). Mekanistisk metod för expansion och lösningsmedelsfri syntes av a-hydroxifosfonater med användning av kaliumfosfat som katalysator. Comptes Rendus Chimie, Vol 16, nummer 2, 2013, sidorna 148-152. Återhämtat sig från Scientedirect.com.
- Venter, E. et al. (2014). Kaliumfhosfat inducerar tolerans anti -instal den ryska vete bladlöss (Duraphis noxia, Homoptera: Aphididae) i vete. Crop Protection Vol 61, juli 2014, sid 43-50. Återhämtat sig från Scientedirect.com.
- Bonturi, n. et al. (2013). Natriumcitrat- och kaliumfosfat som alternativa adsorptionsbuffertar i hydrofob och aromatisk tiofil kromatografisk rening av plasmid -DNA från neutraliserat lysat. Journal of Chromatography B, Volumes 919-920, 2013, sidor 67-74. Återhämtat sig från Scientedirect.com.
- Conrad, r. och klose, m. (2005). Effekt av kaliumfosfatgödsling på produktion och utsläpp av metan och dess 13C-stabil isotopkomposition i rismikrokosmos. Jordbiologi och biokemi, vol 37, nummer 11, 2005, sidorna 2099-2108. Återhämtat sig från Scientedirect.com.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Rökfot. (2019). Tipotassiumfosfat. Hämtas från.Wikipedia.org
- « Egenskaper Inmatningsenheter, vad är användning, typer, exempel
- Tumörnekrosfaktor (TNF) struktur, verkningsmekanism, funktion »

