Mellanfilamentstruktur, typer, funktioner
- 3377
- 645
- Lars Eriksson
De mellanfilament, Också känd i litteraturen som ”IFS” (från engelska Mellanfilames), är en familj av olösliga cytosoliska fibrösa proteiner som finns i alla multicellulära eukaryota celler.
De är en del av cytoskeletten, som är ett intracellulärt filamentöst nätverk som huvudsakligen är ansvarigt för stödet av cellstrukturen och olika metaboliska och fysiologiska processer såsom transport av vesiklar, rörelse och cellförskjutning, etc.
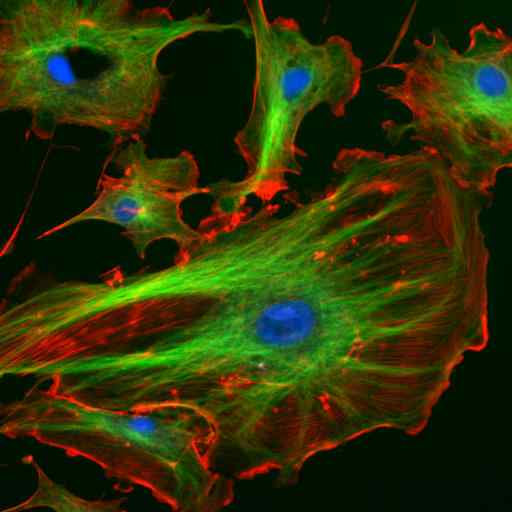
 Mikroskopi genom immunofluorescens av två proteiner från mellanfilamenten av astrocyter (vimentina och GFAP) (källa: Gerryshaw [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Mikroskopi genom immunofluorescens av två proteiner från mellanfilamenten av astrocyter (vimentina och GFAP) (källa: Gerryshaw [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Tillsammans med mikrotubuli och mikrofilament deltar mellanfilament i den rumsliga organisationen av intracellulära organeller, i endocytos och exocytosprocesser och även i processerna för celldelning och intercellulär kommunikation.
De första mellanliggande filamenten som studerades och beskrevs var keratinerna, en av de första typerna av proteiner vars struktur analyserades med röntgendiffraktion på 1930 -talet.
Begreppet mellanliggande filament introducerades emellertid på 1980 -talet av Lazarides, som beskrev dem som "mekaniska integratorer av cellutrymme", kännetecknad av deras olöslighet och deras förmåga att återensera In vitro Efter denaturering.
Många författare betraktas som de "dämpande" elementen av stress för djurceller, eftersom de är mer flexibla filament än mikrotubuli och mikrofilament. De finns inte bara i cytoskeletten, utan de är också en del av nukleoesqueleto.
Till skillnad från de andra fibrösa komponenterna i cytoskeletten deltar inte mellanfilament inte direkt i cellmobilitetsprocesser, utan arbetar i strukturellt underhåll och mekanisk resistens hos celler.
[TOC]
Strukturera
 Källa: http: // RSB.Info.Nih.Gov/ij/bilder/[public domain]
Källa: http: // RSB.Info.Nih.Gov/ij/bilder/[public domain] Mellanfilamenten har en ungefärlig diameter på 10 nm, strukturell egenskap genom vilken de namngavs, eftersom deras storlek är mellan storleken som motsvarar myosin- och aktinfilamenten, som är cirka 25 nm respektive 7 nm.
De skiljer sig strukturellt från de andra två typerna av cytoskelettfilament, som är kulaproteinpolymerer, i vilka deras beståndsdelar är olika a-helikoidala fibrösa proteiner av stor längd som är grupperade från varandra för att bilda strukturer i form av rep eller rep.
Alla proteiner som utgör mellanliggande filament har en liknande molekylär organisation, som består av en a-helicid- eller "rep" -domän som har olika mängder "spolformatorer" -segment av samma storlek.
Denna spiralformade domän är flankerad av ett icke-terminalt "huvud" och en icke-hypoidal "svans" i den C-terminala änden, och båda varierar både i storlek och aminosyrasekvens.
Inom sekvensen av dessa två ytterligheter är konsensusskäl som är vanliga för de 6 typerna av kända mellanliggande filament.
I ryggradsdjur har "rep" -domänen för proteinet från de mellanliggande cytosoliska filamenten cirka 310 aminosyravfall, medan de cytosoliska proteinerna i ryggradslösa och kärnlaminatet har cirka 350 aminosyror i längd.
Kan tjäna dig: Reptiler: Vad är, egenskaper, klassificering, reproduktionhopsättning
Mellanfilament är "självmontering" -strukturer som inte har enzymatisk aktivitet, vilket också skiljer dem från deras cytoskeletala motsvarigheter (mikrotubulor och mikrofilament).
Dessa strukturer monteras initialt som tetramer av filamentösa proteiner som omfattar dem under påverkan av endast monovalenta katjoner.
Dessa tetramerer är 62 nm långa och deras monomerer är associerade med varandra i sidled för att bilda "enheter av längd" (UFL, av engelska Enhetsfilmer), Vad som kallas fas 1 i församlingen, som inträffar mycket snabbt.
UFL: erna är föregångarna till de långa filamenten och eftersom dimererna som omfattar dem binder varandra på en antiparalle och förskjuten sätt, har dessa enheter en central domän med två flankerande domäner genom vilka fas 2 av töjningen inträffar, där längdföreningen av andra UFL: er ges.
Under det som har kallats som fas 3 i enheten inträffar den radiella komprimeringen av filamentens diameter, vilket producerar de mogna mellanliggande filamenten på mer eller mindre 10 nm i diameter.
Funktioner
Funktionerna hos mellanliggande filamenten beror avsevärt på den typ av cell som beaktas och när det gäller djur (inklusive människor) regleras deras uttryck på ett vävnadsspecifikt sätt, så det beror också på typen av vävnad än under studie.
Epitel, muskler, mesenkym och glor och neuroner har olika typer av filament, specialiserade enligt funktionen hos cellerna som de tillhör.
Bland dessa funktioner är de viktigaste strukturella underhållet av celler och resistens mot olika mekanisk stress, eftersom dessa strukturer har viss elasticitet som gör att de kan dämpa olika typer av krafter som åläggs celler.
Typer av mellanfilament
Proteiner som utgör mellanliggande filament tillhör en stor och heterogen familj av filamentösa proteiner som är kemiskt olika men skiljer sig i sex klasser enligt deras homologi av sekvenser (I, II, III, IV, V och VI).
Även om det inte är särskilt vanligt, olika typer av celler, under mycket speciella förhållanden (utveckling, cellomvandling, tillväxt, etc.) De kan samuttrycker mer än en klass mellanliggande filament som bildar proteiner
Klass I och II av mellanliggande filament: syra och grundläggande keratiner
Keratinerna representerar de flesta proteiner från mellanfilament och hos människor representerar dessa mer än tre fjärdedelar av mellanfilamenten.
De har molekylvikter som varierar mellan 40 och 70 kDa och skiljer sig från andra mellanliggande filamentproteiner på grund av deras höga innehåll i glycin och serin.
Kan tjäna dig: igelkottar: egenskaper, livsmiljö, reproduktion, matDe är kända som syra och grundläggande keratiner för sina isoelektriska punkter, som är mellan 4.9 och 5.4 för sura keratiner och mellan 6.1 och 7.8 för grunderna.
I dessa två klasser har cirka 30 proteiner beskrivits och finns särskilt i epitelceller, där båda typerna av protein "sampolimeriserar" och bildar sammansatta filament.
Många av fallet i keratiner av mellanliggande filament finns i strukturer som hår, naglar, horn, spikar och klor, medan klass II är de vanligaste i cytosol.
Klass III av mellanliggande filament: Demin/vimentintypsproteiner
Fallen är ett surt protein på 53 kDa som, beroende på dess grad av fosforylering, har olika varianter.
Vissa författare har också kallat filamenten för att falla som "muskel mellanliggande filament", eftersom deras närvaro är ganska begränsad, även om i små mängder, alla typer av muskelceller.
I myofibriller finns fallen i linje Z, så man tror att detta protein bidrar till de kontraktila funktionerna hos muskelfibrer när man arbetar i föreningen av myofibrillas och plasmamembran.
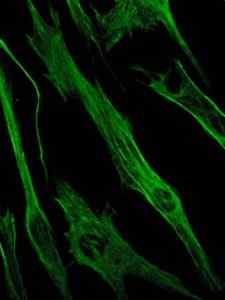 Fotografi av färgningen av vimentinproteinet, ett protein av mellanliggande filamenten i epitel- och embryonala celler (källa: Viktoriia Kosach [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Fotografi av färgningen av vimentinproteinet, ett protein av mellanliggande filamenten i epitel- och embryonala celler (källa: Viktoriia Kosach [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) I sin tur är vimentin ett protein närvarande i mesenkymala celler. De mellanliggande filamenten som bildas av detta protein är flexibla och det har fastställts att de motstår många av de konformationella förändringarna som inträffar under cellcykeln.
Det finns i fibroblaster, i glatta muskelceller, i vita blodkroppar och andra celler i djurcirkulationssystemet.
Klass IV av mellanliggande filament: Neurofilamentösa proteiner
Även känd som "neurofilament", denna typ av mellanliggande filament inkluderar ett av de grundläggande strukturella elementen i axoner och neuronala dendriter; De är ofta associerade med mikrotubulorna som också utgör dessa strukturer.
Neurofilament av ryggradsdjur har isolerats, vilket bestämmer att det är en 200, 150 och 68 KDA -proteintripp som deltar i montering In vitro.
De skiljer sig från andra mellanliggande filament där de har sidoarmar som ”bilagor” som projiceras från deras periferi och som fungerar i samspelet mellan angränsande filament och andra strukturer.
Glialceller producerar en speciell typ av mellanliggande filament som kallas glial mellanliggande filament, som strukturellt skiljer sig från neurofilament, eftersom de består av ett enda 51 kDa -protein och som har olika fysikalisk -kemiska egenskaper.
Klass V av mellanliggande filament: Kärnlamina filament
Alla ark som är en del av nukleoesqueleto är faktiskt mellanliggande filamentproteiner. Dessa har mellan 60 och 75 kDa molekylvikt och finns i kärnorna i alla eukaryota celler.
Kan tjäna dig: Trichuris TrichiuraDe är viktiga för den interna organisationen av kärnkraftsregionerna och för många av funktionerna för denna väsentliga organell för att det finns eukaryoter.
Klass VI för mellanliggande filament: Nestines
Denna typ av mellanliggande filament väger mer eller mindre 200 kDa och är främst i stamcellerna i centrala nervsystemet. De uttrycks under neuronal utveckling.
Relaterade patologier
Det finns flera sjukdomar hos människor som hänför sig till mellanliggande filament.
I vissa typer av cancer såsom maligna melanom eller bröstkarcinom, till exempel leder samuttrycket av mellanliggande vimentin och keratinfilament till differentiering eller sammankoppling av epitel- och mesenkymala celler.
Det har visats experimentellt att detta fenomen ökar den migrerande och invasiva aktiviteten hos cancerceller, vilket har viktiga konsekvenser i metastatiska processer som är karakteristiska för detta tillstånd.
Eriksson och kollaboratörer (2009) granskar de olika typerna av sjukdomar och deras relation till specifika mutationer i generna som är involverade i bildandet av de sex typerna av mellanliggande filament.
Sjukdomar relaterade till kodande genmutationer för de två typerna av keratin är bullast epidermolys, epidermolytisk hyperkeratos, hornhinnedystrofi, keratodermier och många andra.
Typ III Intermediärfilament är involverade i många kardiomyopatier och olika muskelsjukdomar relaterade till huvudsak med dystrofier. Dessutom är de också ansvariga för dominerande grå starr och vissa typer av skleros.
Många neurologiska syndrom och störningar är relaterade till typ IV -filament, såsom Parkinson Parkinson. På liknande sätt är genetiska defekter i typ V- och VI -filament ansvariga för utvecklingen av olika autosomala sjukdomar och relaterade till att cellkärnan fungerar.
Exempel på dessa är Hutchinson-Gilford Progeria-syndrom, Emery-Dreifuss muskeldystrofi, bland andra.
Referenser
- Anderton, f. H. (1981). Mellanfilamlar: En familj av homologa strukturer. Journal of Muscle Research and Cell Motility, 2(2), 141-166.
- Eriksson, J. OCH., Pallari, h., Robert, D., Eriksson, J. OCH., Dechat, t., Grin, B.,... Goldman, R. D. (2009). Introduktion av mellanliggande filamorer: Från upptäckt till sjukdom. Journal of Clinical Investigation, 119(7), 1763-1771.
- Fuchs, e., & Weber, K. (1994). Mellanfilamlar: Struktur, dynamik, funktion och sjukdom. Annu. Varv. Biokemi., 63, 345-382.
- Hendrix, m. J. C., Seftor, e. TILL., Chu och. W., Trevor, k. T., & Seftor, r. OCH. B. (nitton nittiosex). Roll av mellanprodukter i migration, invasion och metastas. Cancer- och metastasrecensioner, femton(4), 507-525.
- Herrmann, h., & Aebi, u. (2004). Mellanfilames: molekylstruktur, monteringsmekanism och integration i funktionellt intracellulära ställningar distinkta. Årlig översyn av biokemi, 73(1), 749-789.
- Herrmann, h., & Aebi, u. (2016). Mellanfilamlar: Struktur och montering. Kall vår hamnperspektiv i biologi, 8, 1-22.
- McLean, jag., & Lane, f. (nittonhundranittiofem). Mellanfilamorer i Diew. Nuvarande åsikt i cellbiologi, 7(1), 118-125.
- Steinert, s., & Roop, D. (1988). Molekylär och cellulär biologi av mellanfilmer. Årlig översyn av biokemi, 57(1), 593-625.
- Steinert, s., Jones, J., & Goldman, r. (1984). Mellanfilames. Journal of Cell Biology, 99(1), 1-6.
- « Gastrotriska egenskaper, livsmiljöer, reproduktion, mat
- Mjuka moskéegenskaper, taxonomi, livsmiljöer, användningar »

