Fluororhistoria, egenskaper, struktur, erhållning, risker, användningar
- 3414
- 524
- Johan Gustafsson
han fluor Det är ett kemiskt element som representeras med F -symbolen och huvudgruppen 17, till vilken halogenerna tillhör. Det kännetecknas ovanför de andra elementen i den periodiska tabellen för att vara det mest reaktiva och elektronegativa; reagerar nästan med alla atomer, så det bildar otaliga salter och organisatoriska föreningar.
Under normala förhållanden är det en ljusgul gas som kan förväxlas med gulgrön. I flytande tillstånd, som visas i den nedre bilden, intensifieras dess gula färg lite mer, vilket försvinner helt när det stelnar i sin fryspunkt.
 Flytande fluor i ett provrör. Källa: Fulvio314 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Flytande fluor i ett provrör. Källa: Fulvio314 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Det är en sådan reaktivitet, trots den flyktiga gasen, som förblir fångad i jordskorpan; särskilt i form av fluoritmineral, känd för sina violetta kristaller. På samma sätt gör dess reaktivitet det till ett potentiellt farligt ämne; reagera kraftigt med allt som berör och bränner i lågor.
Många av dess härledda produkter kan dock vara ofarliga och till och med fördelaktiga, beroende på deras tillämpningar. Till exempel består den mest populära användningen av fluor, tillsatt i sin joniska eller mineralform (såsom fluoridsalter) av framställningen av tandpasta med fluor, som hjälper till att skydda tandemaljen.
Fluor presenterar den egenhet som höga antal eller oxidationstillstånd kan stabilisera för många andra element. Ju större antal fluoratomer, desto mer reaktiv blir föreningen (såvida det inte är en polymer). På samma sätt kommer dess effekter med molekylmatriser att öka; för bättre eller sämre.
[TOC]
Historia
Fluoritanvändning
1530 upptäckte den tyska mineralogisten Georgius Agricola att Fluorspar Mineral kunde användas vid metallrening. Fluorspar är ett annat namn för fluorit, ett fluormineral som bestod av kalciumfluorid (CAF2).
Fluorelementet hade inte upptäckts då och "fluoir" i fluoriten kom från det latinska ordet "fluere" som betyder "flöde"; Sedan var detta vad fluorspar eller fluorit gjorde med metaller: det hjälpte dem att lämna provet.
Beredning av fluorinsyra
1764 lyckades Andreas Sigismud Margraff. Glasåtervänd smält av verkan av syra, så glaset ersattes av metaller.
Det tillskrivs också Carl Scheele 1771, beredningen av syra med samma metod följt av Margraff. År 1809 föreslog den franska forskaren Andre-Marie Ampere att fluoriska eller fluorhorinsyra var en förening som bildades av väte och ett nytt element som liknar klor.
Forskare försökte isolera fluor genom användning av fluorhorisk syra under lång tid; Men dess fara gjorde framsteg i detta avseende.
Humphry Davy, Joseph Louis Gay-Lussac och Jacques Thénard hade stark smärta vid inandning av vätefluoriden (fluoridsyra utan vatten och i gasform))). Under liknande omständigheter dog forskarna Paulin Louyet och Jerome Nickles av förgiftning.
Edmond Fréme, den franska forskaren, försökte skapa torr fluorhoridsyra för att undvika toxiciteten för vätefluorid genom försurning av kaliumbifluorid (KHF2), Men under elektrolys fanns ingen ledning av elektrisk ström.
Isolering
1860 försökte den engelska kemisten George Gore. Det fanns emellertid en explosion genom att våldsamt rekombera väte med fluor. Gore tillskrev explosionen till ett syreläckage.
1886 lyckades den franska kemisten Henri Moisson isolera fluorid för första gången. Tidigare avbröts Moissons arbete fyra gånger på grund av allvarlig förgiftning med vätefluorid, medan han försökte isolering av elementet.
Moisson var en frony student och var baserad på sina experiment för att isolera fluorid. Moisson som används i elektrolys en blandning av kaliumfluorid och fluorhorhorinsyra. Den resulterande lösningen LED -elektricitet och fluorgas som ackumulerades i anoden; det vill säga i den positivt laddade elektroden.
Moisson använde en korrosionsbeständig utrustning, där elektroderna gjordes av en platina och iridiumlegering. I elektrolys använde den en platinabonerare och kylde den elektrolytiska lösningen vid en temperatur av -23 ºF (-31 ºC).
Slutligen, den 26 juni 1886, lyckades Henri Moisson isolera Fluoride, ett verk som tillät honom att vinna Nobelpriset 1906.
Fluorintresse
Under ett tag förlorades intresset för utredning med fluorid. Utvecklingen av Manhattan -projektet för produktion av atombomben.
Det amerikanska företaget DuPont utvecklade, mellan 1930 och 1940, fluorerade produkter såsom klorfluorokarbonater (Freon-12), som användes som kylmedel; och polytetrafluoroetylenplast, känd bäst med namnet Teflon. Detta gav en ökning av fluorproduktionen och konsumtionen.
1986, på en konferens för ett sekel av fluorisolering, den amerikanska kemisten Karl eller. Christe presenterade en kemisk metod för framställning av fluor genom reaktion mellan K2Mnf6 och SBF5.
Kan tjäna dig: polyvinylalkoholFysiska och kemiska egenskaper
Utseende
Fluor är en ljusgul gas. I flytande tillstånd är det ljusgult. Samtidigt kan det fasta ämnet vara ogenomskinligt (alfa) eller transparent (beta).
Atomantal (z)
9.
Atomvikt
18 998 U.
Smältpunkt
-219.67 ºC.
Kokpunkt
-188.11 ºC.
Densitet
Vid rumstemperatur: 1 696 g/l.
Vid smältpunkten (vätska): 1 505 g/ml.
Förångningsvärme
6.51 kJ/mol.
Molorisk kapacitet
31 J/(mol · k).
Ångtryck
Vid en temperatur på 58 K har 986,92 atm ångtryck.
Värmeledningsförmåga
0,0277 w/(m · k)
Magnetisk ordning
Diamagnetisk
Lukt
Kryddig och penetrerande karakteristisk lukt, detekterbar även vid 20 ppb.
Oxidationsnummer
-1, som motsvarar fluoridjon, f-.
Joniseringsenergi
-Först: 1.681 kJ/mol
-Andra: 3.374 kJ/mol
-Tredje: 6.147 kJ/mol
Elektronnegativitet
3.98 på Pauling -skalan.
Det är det kemiska elementet med det största av elektronegativiteter; det vill säga det har en hög affinitet för elektronerna i atomerna som den är kopplad. På grund av detta genererar fluoratomer stora dipolmoment i specifika regioner i en molekyl.
Hans elektronegativitet har också en annan effekt: atomer kopplade till honom förlorar så mycket elektronisk densitet att de börjar få en positiv belastning; Detta är ett positivt oxidationsnummer. Ju mer fluoratomer i en förening kommer den centrala atomen att ha ett mer positivt oxidationsnummer.
Till exempel i OF2 Syre har ett oxidationsnummer +2 (eller2+F2-); I UF6, Uran har ett oxidationsnummer +6 (u6+F6-); Detsamma gäller för svavel i SF6 (S6+F6-); Och slutligen är AGF2, där silver till och med har ett oxidationsnummer +2, ovanligt i det.
Därför lyckas elementen delta med sina mest positiva oxidationsnummer när de bildar föreningar med fluor.
Oxiderande medel
Fluor är det mest kraftfulla oxiderande elementet, så inget ämne kan oxidera det; Och av denna anledning är han inte fri i naturen.
Reaktivitet
Fluor kan kombinera med alla andra element, utom med helium, neon och argon. Det attackerar inte heller sött stål eller koppar vid normala temperaturer. Reagera våldsamt med organiska material, såsom gummi, trä och tyg.
Fluoren kan reagera med den ädla gasen Xenon för att bilda den starka difluoruro -oxidanten av Xenon, XEF2. Det reagerar också med väte för att bilda en halogenid, vätefluorid, HF. I sin tur löses vätefluorid i vatten för att producera den berömda fluorhorhorinsyran (Eat Glass).
Syran hos hydassyror, klassificerade i ökande ordning är:
Hf < HCl < HBr < HI
Kalpitalsyra reagerar med fluor för att bilda fluornitrat, FNO3. Samtidigt reagerar saltsyra kraftigt med fluor för att bilda HF, av2 och CLF3.
Elektronisk struktur och konfiguration

Diatomisk molekyl
 Fluoridmolekyl representerad med rymdfyllningsmodell. Källa: Gabriel Bolívar.
Fluoridmolekyl representerad med rymdfyllningsmodell. Källa: Gabriel Bolívar. Fluoratomen i sitt basala tillstånd har sju elektroner av Valencia, som finns i Orbitals 2s och 2p enligt den elektroniska konfigurationen:
[Han] 2s2 2 p5
Valencia Link Theory (TEV) konstaterar att två fluoratomer, F, är kovalent kopplade för att kunna slutföra sin oktett i Valencia vardera.
Detta inträffar snabbt eftersom det knappt saknar en elektron för att bli isolektronisk till ädla neongas; Och dess atomer är mycket små, med en mycket stark effektiv kärnbelastning som lätt kräver elektroner i miljön.
Molekylen f2 (Överlägsen bild), har en enkel kovalent länk, F-F. Trots dess stabilitet jämfört med fria F -atomer är det en extremt reaktiv molekyl; Homonukleär, apolär och ivrig efter elektroner. Det är därför fluor, som f2, Det är en mycket giftig och farlig art.
Eftersom f2 Det är apolar, dess interaktioner beror på dess molekylmassa och London -dispersionsstyrkorna. Vid någon tidpunkt måste det elektroniska molnet runt båda F -atomerna deformera och komma från en omedelbar dipol som inducerar en annan i en angränsande molekyl; så att de är långsamt och svaga.
Flytande och solid
Molekylen f2 Det är väldigt litet och sprider sig i rymden med relativ hastighet. I sin gasfas uppvisar den en ljusgul färg (som kan förväxlas med en limegrön). När temperaturen sjunker till -188 ºC blir spridningskrafterna mer effektiva och gör molekylerna F2 sammanhållning tillräckligt för att definiera en vätska.
Den flytande fluoren (första bilden), ser ännu mer gul ut än dess respektive gas. I den, molekylerna f2 De är närmare och interagerar med ljuset i högre grad. Intressant nog, när det förvrängda kubikglaset bildas från fluor till -220 ºC, bleknar färgen och förblir ett transparent fast ämne.
Kan tjäna dig: grenade alkanerNu när M -molekylerna2 De är så nära (men utan att deras molekylrotationer stannar) verkar det som om deras elektroner tjänar viss stabilitet och därför är deras elektroniska hopp för stort för att ljuset till och med ska interagera med glaset.
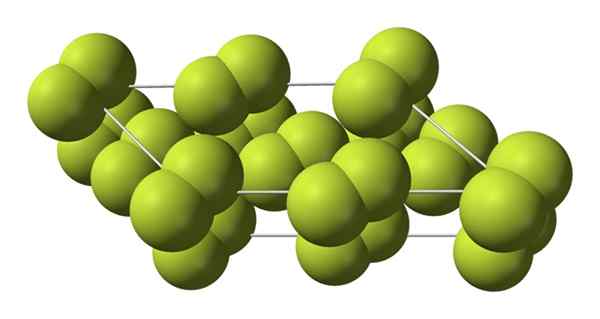
Kristallinfaser
Denna kubiska kristall motsvarar ß -fasen (den är inte en alotropisk eftersom den förblir samma F2). När temperaturen sjunker ännu mer, upp till -228 ºC, lider den fasta fluoren en fasövergång; Det kubiska glaset omvandlas till en monoklinisk, a -fasen:
 Kristallin struktur i alfa -fasen av fluor. Källa: Benjah-Bmm27 [Public Domain].
Kristallin struktur i alfa -fasen av fluor. Källa: Benjah-Bmm27 [Public Domain]. Till skillnad från ß-f2, A-F2 är ogenomskinlig och svår. Kanske beror det på att M -molekylerna2 De har inte längre sådan frihet att rotera i sina fasta positioner i monokliniska kristaller; där de interagerar i större utsträckning med ljuset, men utan att väcka sina elektroner (vilket skulle ytligt förklara deras opacitet).
Den kristallina strukturen hos a-F2 Det var svårt att studera genom konventionella X -Ray -diffraktionsmetoder. Detta beror på att övergången från fas ß till a är mycket exoterm; Så kristallen utnyttjas praktiskt taget, medan den interagerar lite med strålning.
De tillbringade cirka femtio år innan tyska forskare (Florian Kraus och kollaboratörer), dechiffrerade helt a-F-strukturen2 Med större precision tack vare neutrondiffraktionstekniker.
Var är det och få
Fluor upptar den 24: e av de vanligaste elementen i universum. Men på jorden är i mässan 13vo element, med en koncentration av 950 ppm i jordskorpan och en koncentration av 1,3 ppm i havsvatten.
Jordarna har en fluorkoncentration mellan 150 och 400 ppm, och på vissa jordar kan koncentrationen nå 1.000 ppm. I den atmosfäriska luften finns den i en koncentration av 0,6 ppb; Men det har registrerat sig i vissa städer upp till 50 ppb.
Fluor erhålls främst från tre mineraler: fluorit eller fluorospar (kaffe2), Fluoroapatita [ca5(PO4)3F] och kreolen (na3Alf6).
Fluoritbehandling
Efter att ha samlat klipporna med fluoritmineralet är dessa föremål för primär och sekundär krossning. Med den sekundära krossningen av att få mycket små stenfragment.
Sedan tas bergfragment till en bollverk för dammreduktion. Vatten och reagens tillsätts för att bilda en pasta, som placeras i en flotationstank. Det injiceras med tryck för att bilda bubblor, och därmed hamnar fluoriten på den vattenhaltiga ytan.
Silikater och karbonater är sediment medan fluorit samlas in och leder till torkande ugnar.
När fluoriten har erhållits reageras den med svavelsyra för att producera vätefluorid:
Kaf2 + H2Sw4 => 2 HF +-fall4
Vätefluoridelektrolys
I fluorproduktion följs vissa modifieringar, med metoden som används av Moisson 1886.
En elektrolys av en blandning av smält kaliumfluorid och fluohydronsyra görs, med en molradie på 1: 2,0 till 1: 2.2. Den smälta salttemperaturen är 70 - 130 ºC.
Katoden består av en monet eller stållegering, och anoden är av reografering av kol. Fluorproduktionsprocessen under elektrolys kan schematiseras enligt följande:
2hf => h2 + F2
Vatten används för att kyla elektrolyskammaren, men temperaturen måste vara över smältpunkten för elektrolyten för att undvika stelning. Väte som produceras i elektrolys uppsamlas i katoden, medan fluor i anoden.
Isotoper
Fluoren har 18 isotoper, är den 19F den enda stabila isotopen med 100% överflöd. han 18F har ett halvt liv på 109,77 minuter och är den radioaktiva isotopen av fluor med den största halvlivet. han 18F det används som en positronkälla.
Biologiskt papper
Ingen metabolisk aktivitet av fluor hos däggdjur eller övre växter är känd. Vissa havsväxter och svampar syntetiserar emellertid monofluroacetat, en giftig förening, som använder som skydd för att undvika förstörelse.
Risker
Överdriven fluorförbrukning har associerats med benfluoros hos vuxna och tandfluoros hos barn, liksom med förändringar i njurfunktion. Av denna anledning föreslog USA: s folkhälsovård (PHS) att fluoridkoncentrationen i dricksvatten inte skulle vara större än 0,7 mg/L.
Samtidigt konstaterade USA: s Enviromental Protection Agency (EPA) att koncentrationen av fluor i dricksvatten inte skulle vara större än 4 mg/L, för att undvika skelettfluoros, där fluor samlas i benen. Detta kan orsaka benförsvagning och frakturer.
Fluor har varit relaterat till skador på paratyreoidkörteln, med en minskning av kalcium i benstrukturer och höga kalciumkoncentrationer i plasma.
Det kan tjäna dig: levande materia: koncept, egenskaper och exempelBland de förändringar som tillskrivs överskott av fluor är följande: tandfluoros, skelettfluoros och skador på paratyroidkörteln.
Tandfluor
Tandfluoros presenteras med små ränder eller motorcyklar i tandemaljen. Barn under 6 år bör inte använda munvatten som innehåller fluor.
Skelettfluoros
Vid skelettfluoros kan smärta och skador på skador diagnostiseras såväl som i lederna. Benet kan härda och förlora elasticitet, vilket ökar risken för sprickor.
Ansökningar
Tandkräm
 Vissa oorganiska salter av fluor används som ett tillsatsmedel i formuleringen av tandpasta, som har visat att de hjälper till att skydda tandemaljen. Källa: Pxhere.
Vissa oorganiska salter av fluor används som ett tillsatsmedel i formuleringen av tandpasta, som har visat att de hjälper till att skydda tandemaljen. Källa: Pxhere. Vi börjar med avsnittet om användningen av fluor med det mest kända: att tjäna som en del av många tandpastor. Detta är inte den enda användningen där kontrasten mellan dess molekyl F kan ses2, extremt giftig och farlig, och anjon f-, Vilket beroende på miljö kan vara fördelaktigt (även om det ibland inte).
När vi äter mat, särskilt godis, försämrar bakterierna dem genom att öka surheten i vår saliv. Sedan finns det en punkt där pH räcker för att försämra och demineralisera tandemaljen; Hydroxiapatit kommer "ner".
I denna process- interagera med CA2+ för att bilda en fluorapatitmatris; mer stabil och varaktig än hydroxyapatit. Eller åtminstone, detta är den föreslagna mekanismen för att förklara fluoridjonens verkan på tänderna. Det är troligt att det är mer komplicerat och att det finns en hydroxyapatit-fluorapatit beroende på pH.
Dessa anjoner f- De finns i Dental Papas i salter; som: NAF, SNF2 (Den berömda stinfluoriden) och Napof. Men koncentrationen av f- Det måste vara lågt (mindre än 0,2%), eftersom det annars orsakar negativa effekter på kroppen.
Vattenfluorisering
Mycket lik hur med tandpasta har fluoridsalter lagts till dricksvattenkällor för att bekämpa utseendet på karies hos dem som dricker det. Koncentrationen måste fortfarande vara mycket lägre (0,7 ppm). Men denna praxis är vanligtvis misstroande och kontrovers, eftersom möjliga cancerframkallande effekter har tillskrivits.
Oxiderande medel
Gasen f2 Det beter sig som ett mycket starkt oxiderande medel. Detta gör att många föreningar ordnar mer än när de utsätts för syre och en värmekälla. Det är därför det har använts i raketbränsleblandningar, där de till och med kan ersätta ozon.
Polymerer
I många användningsområden beror inte fluoridbidrag2 eller f-, men direkt till dess elektronegativa atomer som utgör en del av en organisk förening. Därför i essensen av en C-F-länk.
Beroende på struktur är polymerer eller fibrer med C-F-bindningar vanligtvis hydrofoba, så att de inte blir våta eller motstår attacken av fluorhorinsyra; Eller ännu bättre kan de vara utmärkta elektriska isolatorer och användbara material som föremål som rör och leder tillverkas. Teflon och Navion är exempel på dessa fluorerade polymerer.
Farmaceuter
Reaktiviteten hos fluor kallas dess användning för syntes av flera fluorin, organiska eller oorganiska föreningar. I organiska, speciellt de med farmakologiska effekter, ersätt en av deras heteroátomos med atomer F ökar (positivt eller negativt) dess handling på deras biologiska mål.
Det är därför som läkemedelsindustrin i vissa läkemedel alltid finns på bordet genom att tillsätta fluoratomer.
Mycket liknande förekommer med herbicider och fungicider. Fluoren i dem kan öka sin handling och effektivitet på insekter och svampar.
Glasgravning
Fluorhorinsyra, på grund av dess aggressivitet med glas och keramik, har använts för att spela in tunna och känsliga bitar av dessa material; Vanligtvis avsedda för tillverkning av datormikrokomponenter eller för elektriska glödlampor.
Urananrikning
En av de mest relevanta användningarna av elementär fluor är att hjälpa till att berika uran som 235ELLER. För att göra detta upplöses uranmineraler i fluorhorinsyra och producerar UF4. Denna oorganiska fluorid reagerar sedan med f2, Att förvandlas till UF6 (235Phew6 och 238Phew6).
Därefter, och genom en gascentrifugering, 235Phew6 Det skiljer sig från 238Phew6 och oxideras sedan och lagras som kärnbränsle.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Kreterkatrina. (2019). Frozen Fluores struktur återställdes efter 50 år. Royal Society of Chemistry. Återhämtat sig från: Chemistryworld.com
- Wikipedia. (2019). Fluor. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Fluor. Pubchemdatabas. CID = 24524. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Doktor. Doug Stewart. (2019). Fluorelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Batul Nafisa Baxamusa. (21 februari 2018). Den överraskande vanliga användningen av den mycket reaktiva fluoren. Återhämtat sig från: sciencestruck.com
- Paola Opazo Sáez. (4 februari 2019). Fluor i tandkräm: Är det bra eller dåligt för hälsan? Återhämtat sig från: Nacionfarma.com
- Karl Christe & Stefan Schneider. (8 maj 2019). Fluor: kemiskt element. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Lentech B.V. (2019). Period Tabell: syre. Återhämtat sig från: Lentech.com
- Gagnon Steve. (s.F.). Elementet fluor. Jefferson Lab. Återhämtat sig från: utbildning.Jlab.org
- American Cancer Society Medical and Redaktionellt innehållsteam. (28 juli 2015). Vattenfluoridering och cancerrisk. Återhämtat sig från: cancer.org
- « Exakta vetenskapliga egenskaper, vad studerar du, exempel
- Inga metallhistoria, egenskaper, grupper, användningar »

