Inga metallhistoria, egenskaper, grupper, användningar

- 1848
- 215
- Johan Gustafsson
De inga metaller De är en grupp element som är belägna på höger sida av det periodiska tabellen, med undantag av väte som finns i grupp 1 (AI), tillsammans med alkaliska metaller. Om du vill veta vad de är måste du titta på det övre högra hörnet av P -blocket.
Icke -metallatomer är relativt små och deras yttre elektroniska skikt har ett förhöjt antal elektroner. Bland de icke -metalliska elementen kan fasta ämnen, vätskor och gaser hittas; Även om de mestadels befinner sig i ett gasformigt tillstånd, berikar flera av dem atmosfären.
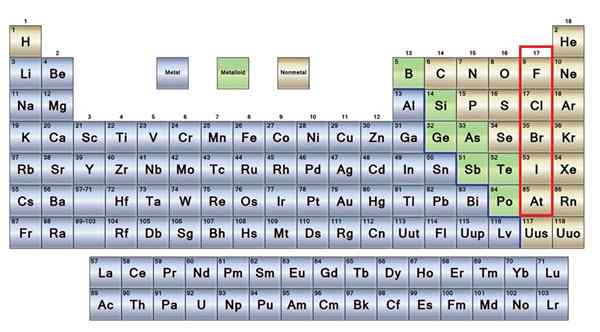 Icke -metalliska element i brunt
Icke -metalliska element i brunt En bra del av icke -metallerna finns i alla levande varelser i form av föreningar och makromolekyler. Till exempel: kol, syre och väte finns i alla proteiner, lipider, kolhydrater och nukleinsyror.
Fosfor finns i alla nukleinsyror och i vissa kolhydrater och lipider. Svavel finns i många proteiner. Kväve är en del av alla nukleinsyror och proteiner.
Å andra sidan är underjordiska, metangaser och oljor råvaror nästan sammansatta av icke -metalliska element. Faktum är att kolväten (kol och väte) ger en uppfattning om hur rikligt med icke -metallerna är trots deras lägre antal element i det periodiska tabellen.
[TOC]
Historia
Från antiken (3750 till.C.) Egyptierna använde kol för att minska koppar som finns i sina mineraler, till exempel Corvelita och Malakiten.
1669 lyckades Hennin -märket isolera insamlad urinfosfor. Henry Cavendish (1776) uppnådde identifiering av väte, även om flera forskare, inklusive Robert Boyle (1670), producerade väte genom att reagera en stark syra med en metall.
Carl Scheele producerade syre genom att värma kvicksilveroxid med nitrater (1771). Curtois lyckades isolera joden medan han försökte förbereda saltpeters från tång (1811). Balard och Gmelin isolerade Bome (1825).
1868, Janssen och Lockger Independent. Moissan lyckades isolera fluorid (1886).
1894 upptäckte Lord Rayleigh och Ramsey argon genom att studera kvävegenskaper. Ramsay och Travers (1898) isolerade Crypton, Neon och Xenon of the Liquid Argon, genom kryogen destillation av luften.
Fysiska och kemiska egenskaper
 Svavel är ett av de mest representativa icke -metalliska elementen. Källa: Ben Mills via Wikipedia.
Svavel är ett av de mest representativa icke -metalliska elementen. Källa: Ben Mills via Wikipedia. Fysisk
Några av de fysiska egenskaperna hos icke -metaller är:
-De har låg elektrisk ledningsförmåga, med undantag för kol i form av grafit, vilket är en bra elektricitetsledare.
Kan tjäna dig: Heptano (C7H16): Struktur, egenskaper och användningar-De kan förekomma under det fysiska utseendet på fasta ämnen, vätskor eller gaser.
-De har låg värmeledningsförmåga, med undantag av kol i form av diamant som inte uppför sig som en värmeisolator.
-De har lite lyster, till skillnad från metallmetallens ljusstyrka.
-Icke -metalliska fasta ämnen är spröda, så de är inte duktila eller formbara.
-De har låga smält- och kokpunkter.
-De kan presentera olika kristallina strukturer. Således har fosfor, syre och fluor en kubisk kristallin struktur; Väte, kol och kväve, hexagonal; och svavel, klor, brom och jod, ortorrombisk.
Kemi
Icke -metaller kännetecknas av att ha hög joniseringsenergi och ett högt elektronegativitetsvärde. Fluor har till exempel den största elektronegativiteten (3.98), som är det mest reaktiva elementet i icke -metaller.
Men överraskande har Noble Gases Helium (5.5) och Neon (4.84) den största elektronegativiteten. De är emellertid kemiskt inerta för att ha yttre elektroniska lager fulla.
Icke -metaller bildar joniska föreningar med metaller och kovalent med icke -metaller.
Icke -metalliska element bildar diatomiska molekyler, kopplade av kovalenta bindningar. Under tiden är atomerna av ädla gaser i form av atomenheter.
De bildar syraoxider som reagerar med vatten har sitt ursprung i syror.
Icke -metall- och elementgrupper

Grupp 1
Det består av väte en färglös och toalettgas, dialotomisk. Oxidationstillstånd +1. Den har mindre densitet än luft. I fast tillstånd presenterar det en hexagonal kristallin struktur. Väte är ett litet reaktivt element.
Grupp 14
Kol är det enda icke -metall som tillhör denna grupp. Kol i form av grafit är ett glansigt fast ämne, med en hexagonal kristallin struktur. Har hög elektrisk konduktivitet. Dess vanligaste oxidationstillstånd är +2 och +4.
Grupp 15
Kväve
Färglös och toalettgas. Det är lite reaktivt element och något tätare än luften. Mer vanliga oxidationstillstånd: -3 och +5. Forma diatomiska molekyler, n2.
Match
Fast, dess färg kan vara vit, gul eller svart. Liten reaktiv. Ortorrombisk kristallin struktur. Elektronegativitet 2,1. Mer vanliga oxidationstillstånd: -3 och +5.
Grupp 16
Syre
Färglös gas eller ljusblå, toalett. I allmänhet inte reaktivt. Kubisk kristallisk struktur. Det är en isolator och ett starkt oxidationsmedel. Elektronegativitet 3.5. Oxidationstillstånd -2
Svavel
Ljusgul fast, sprött, måttligt reaktivt. Ortorrombisk kristallin struktur. Forma kovalenta bindningar. Elektronegativitet 2.5. Mer vanliga oxidationstillstånd: -2, +2, +4 och +6.
Selen
Svart grå eller rödaktig fast. Grå selen visar lätt känslig elektrisk konduktivitet. Det är ett mjukt och sprött fast. Elektronegativitet 2.4. Oxidationstillstånd: -2, +2, +4 och +6.
Kan tjäna dig: kaliumhydroxid: struktur, egenskaper, användningarGrupp 17
Fluor
Det är en ljusgul gas, mycket giftig. Det är ett mycket reaktivt element. Det presenteras som diatomiska molekyler, f2. I fast tillstånd kristalliseras i en kubisk form. Elektronegativitet 3.98. Oxidationstillstånd -1.
Klor
Det är en gröngul gas. Presenterar diatomiska molekyler, Cl2. Det är mycket reaktivt. I fast tillstånd är den kristallina strukturen ortorrombisk. Elektronegativitet 3.0. Oxidationstillstånd: - 1, +1, +3, +5, +7.
Brom
Det är en röd-café-vätska. Elektronegativitet 2.8. Oxidation säger -1, +1, +3, +5 och +7.
Jod
Det är ett svart fast ämne att när det är sublimaterar avger en violett ånga. Ortorrombisk kristallin struktur. Metalljodider är joniska. Elektronegativitet 2.5. Oxidationstillstånd: -1, +1, +3, +5, y +7.
Astato
Det är ett svart fast ämne. Kubisk kristallin struktur centrerad i ansiktet. Elektronegativitet 2,2. Det är ett svagt oxidationsmedel.
Grupp 18
Helium
Har hög värmeledningsförmåga. Elektronegativitet 5.5. Det är kemiskt inert och inte brandfarligt. Låg densitet och hög flytande.
Neon
Hög kylkapacitet i flytande tillstånd. Elektronegativitet 4.84. Det är det minst reaktiva av ädla gaser.
Argon
Det är tätare än luften. Kemiskt inert. Elektronegativitet 3.2.
Krypton
Elektronegativitet 2.94. Kan reagera med fluor för att bilda Crypton Difluoride (KRF2).
Xenon
Korsar blodhjärnbarriären. Svarar på elektrisk strömproducerande ljus. Elektronegativitet 2,2. Komplex form med fluor, guld och syre.
Radon
Det är ett radioaktivt element. Elektronegativitet 2.06. Forma föreningar med fluorid (RNF2) och med syre (RNO3).
Ansökningar
Väte

Det används i raketframdrivning och som bränsle i bilmotorer som använder väte. Det används i ammoniaksyntes (NH3) och i hydreringen av fetter.
Kol
Grafit används vid tillverkning av pennor och högresistensfibrer som används i utarbetandet av sportartiklar. Diamanten används som en juvel med stort värde och i borrningsborrarna som slipmedel. Koldioxid används i utarbetandet av läskedrycker.
Kväve
Det används vid produktion av ammoniak, salpetersyra och urea. Kväve är ett viktigt element för växter och används i gödningsmedelstillverkning.
Match
Vit fosfor används som en raticide, insekticid och i pyroteknisk industri. Röd fosfor används i tillverkning av matcher. Dess föreningar används också i gödningsmedel för gödselmedel.
Syre
Syre används vid utarbetande av stål, plast och textilier. Det används också i raket, syreterapi och andningshjälp i flygplan, ubåtar och rymdflyg.
Kan tjäna dig: erbio: struktur, egenskaper, erhållning, användningSvavel
Det används som råmaterial för produktion av svavelsyra, krutt och i vulkaniseringen av gummi. Sulfiter används för att bleka papper och fungicid.
Selen
Det används för att förmedla en skarlakansröd färg till glaset. Det används också för att neutralisera grönaktig nyans som produceras av glasföroreningar med järnföreningar. Det används i fotoelektriska celler med applicering på dörrar och hissar.
Fluor

Det läggs till tandkrämer för att förhindra karies. Vätefluorid används som råmaterial för teflon. Monoatomic Fluoror används vid tillverkning av halvledare.
Klor
Det används i extraktiv metallurgi och kolväteklorering för tillverkning av olika produkter som PVC. Klor används i blekning av trä och textilmassa. Det används också som ett vattendesinfektionsmedel.
Brom
Det används vid framställning av silverbromid för ljuskänsliga linser och i fotografiska filmer används det också vid utarbetandet av den lugnande natriumbromiden och dibrometanen, en anti -domänkomponent i bensin.
Jod
Kaliumjodid (KI) tillsätts för att förhindra sköldkörtelkanten. Jodtinktur används som antiseptisk och groddmord. Jod är en del av sköldkörtelhormoner.
Helium
Det används vid fyllning av luftballonger och blandas med syre för andning av djupt vatten. Det används för svetsar i en inert atmosfär och hjälper till att upprätthålla mycket låga forskningstemperaturer.
Neon
I glasrör som lyser upp för el (neonröda lampor).
Argon
Det används för att skapa en atmosfär för svetsning och i fyllning av incandescence -strålkastare.
Xenon
En blandning av Xenon och Crypton används i produktionen av blinkningar med stor intensitet på kortvarig fotografisk utställning.
Radon
Det används vid behandling av cancertumörer genom strålbehandling.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Mathews, C. K., Van Holde, K. OCH. Och Ahern, K. G. (2002). Biokemi. Tredje upplagan. Redigera. Pearson-addison wesley
- Helmestine, Anne Marie, PH.D. (6 oktober 2019). Vilka är egenskaperna hos icke -metaller? Återhämtat sig från: tankco.com
- Wikipedia. (2019). Icke -metalisk. Hämtad från: i.Wikipedia.org
- Redaktörerna för Enyclopaedia Britannica. (5 april 2016). Icke -metalisk. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Jose M. Gavira Vallejo. (27 januari 2016). Vad är pnikogenerna? Och icosogenos, kristallogenerna, kalkogenerna .. ? Hämtad från: triplenlace.com
- « Fluororhistoria, egenskaper, struktur, erhållning, risker, användningar
- Vad är, typer och egenskaper »

