Magnesiumfosfat (Mg3 (PO4) 2)
- 956
- 213
- Per Karlsson
 Struktur och formel av magnesiumfosfat
Struktur och formel av magnesiumfosfat Vad är magnesiumfosfat?
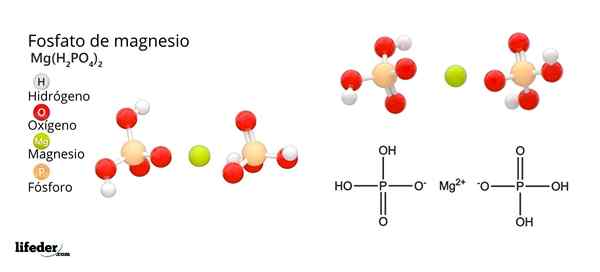
han Magnesiumfosfat Det är en term som används för att hänvisa till en familj av oorganiska föreningar som bildas av magnesium, alkalisk metall och fosfatoxoanion. Det enklaste magnesiumfosfatet har en mg kemisk formel3(PO4)2. Formeln indikerar att för varje två anjoner po43- Det finns tre mg -katjoner2+ interagerar med dessa.
Dessa föreningar kan också beskrivas som magnesiumsalter härrörande från ortofosfahinsyra (h3Po4). Med andra ord "samlas" magnesium "mellan fosfatanoner, oavsett dess oorganiska eller organiska presentation (MGO, MG (NO3)2, Mgcl2, Mg (OH)2, etc.).
På grund av dessa skäl kan magnesiumfosfater hittas som flera mineraler. Några av dessa är: nattit -mg3(PO4)2 · 22h2O-, struvita -(nh4) Mgpo4· 6h2Eller vars mikrokristaller är representerade i den överlägsna bilden-, holtedalita -mg2(PO4) (OH) - och bobierrite -mg3(PO4)2· 8h2ANTINGEN-.
När det gäller bobierriten är dess kristallina struktur monoklinisk, med kristallina aggregat med massiva fläktar och rosetter. Magnesiumfosfater kännetecknas emellertid av att uppvisa en rik strukturell kemikalie, vilket innebär att deras joner antar många kristallina arrangemang.
Magnesiumfosfatformer och deras lasters neutralitet
Magnesiumfosfater härstammar från ersättningen av H -protoner3Po4. När ortofosforsyra förlorar en proton förblir det som fosfatdihydrogenjon2Po4-.
Hur man neutraliserar den negativa belastningen för att orsaka ett magnesiumsalt? Ja mg2+ Står för två positiva avgifter och behöver sedan två timmar2Po4-. Således erhålls magnesium diácido -fosfat, mg (h2Po4)2.
Sedan, när syran tappar två protoner, kvarstår vätfosfatjonen, HPO42-. Nu hur man neutraliserar dessa två negativa laddningar? Som MG2+ Du behöver bara två negativa avgifter för att neutralisera, interagera med en enda hpo -jon42-. På detta sätt erhålls magnesiumsyrafosfat: MGHPO4.
Kan tjäna dig: magnesiumoxid: struktur, egenskaper, nomenklatur, användningSlutligen, när alla protoner går förlorade, kvarstår fosfatjonen43-. Detta kräver tre mg -katjoner2+ och från ett annat fosfat att montera i ett kristallint fast ämne. Matematisk ekvation 2 (-3) + 3 (+2) = 0 hjälper till att förstå dessa stökiometriska proportioner för magnesium och fosfat.
Som ett resultat av dessa interaktioner produceras tribasiskt magnesiumfosfat: MG3(PO4)2. Varför är Tribasic? Eftersom han kan acceptera tre H: s motsvarande+ För att bilda H igen3Po4:
Po43-(AC) + 3H+(Ac) h3Po4(Ac)
Magnesiumfosfater med andra katjoner
Kompensation av negativa avgifter kan också uppnås med deltagande av andra positiva arter.
Till exempel för att neutralisera PO43-, K -jonerna+, Na+, RB+, Nh4+, etc., De kan också ingripa, bilda förening (x) mgpo4. Om X är lika med NH4+, Det vattenfria struvitmineralet bildas, (NH4) Mgpo4.
Ge. Tack vare detta kan många magnesiumfosfatkristaller syntetiseras (NA3Rbmg7(PO4)6, Till exempel).
Strukturera

Den överlägsna bilden illustrerar interaktioner mellan Mg -joner2+ och po43- som definierar den kristallina strukturen. Det är emellertid bara en bild som visar snarare den tetraedrala geometrien hos fosfater. Sedan innebär den kristallina strukturen fosfat- och magnesiumsfärer tetrahedra.
När det gäller MG3(PO4)2 Vattenfri, jonerna adopterar en rhombohedral struktur, där MG2+ är koordinerad med sex atomer av O.
Ovanstående illustreras i den nedre bilden, med den dimension som de blå sfärerna är kobolt, bara ändrar dem för de gröna sfärerna av magnesium:
Kan tjäna dig: icke -järnlegeringar: struktur, egenskaper, användningar, exempel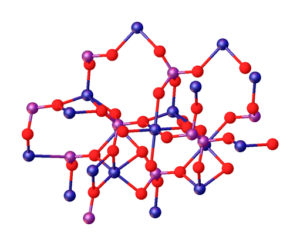
Precis i mitten av strukturen kan Octaedro som bildas av de sex röda sfärerna runt den blåaktiga sfären lokaliseras.
Dessa kristallina strukturer kan också acceptera vattenmolekyler och bilda magnesiumfosfathydrater.
Detta beror på att de bildar vätebroar med fosfatjoner (HOH-O-PO33-). Dessutom kan varje fosfatjon acceptera upp till fyra vätebroar; det vill säga fyra vattenmolekyler.
Som MG3(PO4)2 Den har två fosfater, kan acceptera åtta vattenmolekyler (vilket händer med Bobierrite Mineral). I sin tur kan dessa vattenmolekyler bilda vätebroar med andra eller interagera med de positiva MG -centra2+.
Egenskaper
Det är en vit fast, bildande kristallina rombiska plattor. Det har inte heller någon lukt och smak.
Det är mycket olösligt i vatten, även när det är varmt på grund av dess stora kristallina nätverksenergi; Detta är produkten av de starka elektrostatiska interaktionerna mellan de Mg mångsidiga jonerna2+ och po43-.
Det vill säga, när jonerna är mångsidiga och deras joniska radioapparater inte varierar mycket i storlek, visar det fasta motståndet mot dess upplösning.
Smälter till 1184 ºC, vilket också indikerar de starka elektrostatiska interaktionerna. Dessa egenskaper varierar beroende på hur många molekyler av absorberat vatten, och om fosfat är i några av dess protonerade former (HPO42- eller h2Po4-).
Användning/applikationer
Laxativ
Det har använts som laxerande för tillstånd av förstoppning och gastrisk surhet. Men dess skadliga biverkningar - manifesteras av genereringen av diarré och kräkningar - har begränsat deras användning. Dessutom kommer det sannolikt att ge skador på mag -tarmkanalen.
Kan tjäna dig: molekylärt syre: struktur, egenskaper, användningarBenreparation
Användningen av magnesiumfosfat i benvävnadsreparation undersöks för närvarande, vilket undersöker tillämpningen av MG (h2Po4)2 Som cement.
Denna form av magnesiumfosfat uppfyller kraven för detta: det är biologiskt nedbrytbart och histokompatibelt. Dessutom rekommenderas dess användning vid regenerering av benvävnad för dess motstånd och snabb inställning.
Material för ortopedi
Användningen av amorft magnesiumfosfat (AMP) utvärderas som biologiskt nedbrytbar och icke -exotermisk ortopedisk cement. För att generera denna cement blandas amp -pulvret med polyvinylalkohol för att bilda en kitt.
I levande varelser
Magnesiumfosfatens huvudfunktion är att tjäna som ett MG -bidrag till levande varelser. Detta element ingriper i många enzymatiska reaktioner som katalysator eller mellanhand, som är viktigt för livet.
En Mg -brist hos människor är förknippat med följande effekter: minskning av Ca -nivåer, hjärtsvikt, retention av NA, minskade K -nivåer, arytmier, varaktiga muskelkontraktioner, kräkningar, illamående, låga cirkulerande nivåer av paratyreoidhormon och mag- och menstruationskramper, bland andra.
Referenser
- Mineraldatapublicering. (2001-2005). Bobierrit. Återhämtat sig från handbokenofmineralogi.org
- Sahar mousa. (2010). Studie om syntes av magnesiumfosfatmaterial. Fosforforskning Bulletin Vol. 24, sid 16-21.
- Wikipedia. (2018). Magnesiumfosfatstribasic. Hämtas från.Wikipedia.org
- Pub. (2018). Magnesiumfosfat-. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov
- Barbie, E., Lin, b., Goel, v.K. Och Bhaduri, s. (2016) Utvärdering av amorft magnesiumfosfat (AMP) baserat icke-exotermiskt ortopediskt cement. Biomedicinsk matta. Volym 11 (5): 055010.
- Yu och., Yu, ch. Och dai, h. (2016). Förberedelse av nedgångsmagnesiumbencement. Regenerativa biomaterial. Volym 4 (1): 231

