Oxidativa fosforyleringsstadier, funktioner och hämmare
- 936
- 35
- Per Karlsson
De oxidativ fosforylering Det är en process där ATP -molekyler syntetiseras från ADP och PYo (Oorganiskt fosfat). Denna mekanism utförs av bakterier och eukaryota celler. I eukaryota celler utförs fosforylering i mitokondriell matris av icke -fotosyntetiska celler.
ATP -produktion är regisserad genom överföring av elektroner från NADH eller FADH -koenzymer2 till o2. Denna process representerar den största energiproduktionen i cellen och härstammar från nedbrytningen av kolhydrater och fetter.
 Källa: Robot8a [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
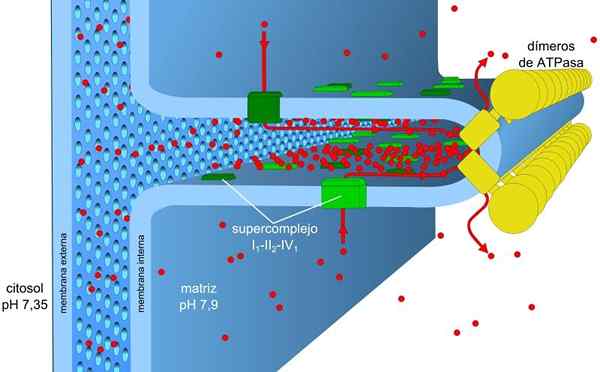
Källa: Robot8a [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Energin lagrad i last- och pH -gradienterna, även känd som protonisk motorkraft, gör att denna process kan genomföras. Protongradienten som genereras gör att den yttre delen av membranet har en positiv belastning på grund av koncentrationen av protoner (h+) och den mitokondriella matrisen är negativ.
[TOC]
Där oxidativ fosforylering inträffar?
Elektrontransport och oxidativa fosforyleringsprocesser är associerade med ett membran. I prokaryoter utförs dessa mekanismer genom plasmamembranet. I eukaryota celler är de associerade med mitokondria -membranet.
Antalet mitokondrier som finns i cellerna varierar beroende på celltypen. Till exempel i däggdjur saknar erytrocyter dessa organeller, medan andra celltyper, såsom muskelceller, kan ha miljoner av dem.
Det mitokondriella membranet består av ett enkelt yttre membran, ett något mer komplex inre membran, och mitt i dem är det intermembranala utrymmet, där många enzymer beroende på ATP finns.
Det yttre membranet innehåller ett protein som kallas porina som bildar kanalerna för enkel diffusion av små molekyler. Detta membran ansvarar för att upprätthålla strukturen och formen på mitokondrierna.
Det inre membranet har större densitet och är rik på protein. Det är också vattentätt för molekyler och joner, så att korsa det, de behöver intermembranala proteiner som transporterar dem.
Inom matrisen sträcker sig vikarna i det inre membranet och bildar åsar som gör att den kan ha ett stort område i en liten volym.
Cellenergi centralt
Mitokondrierna betraktas som cellulärt energicenter. I det finns enzymerna som är involverade i processerna för cytrinsyran, oxidation av fettsyror och redoxenzymer och proteiner vid elektrontransport och doktorsexamen.
Koncentrationsgradienten för protonerna (pH -gradient) och gradienten för belastningar eller elektrisk potential i det inre membranet i mitokondrierna, är orsaken till den protoniska motorkraften. Den lilla permeabiliteten hos det inre membranet för joner (annat än h+) tillåter mitokondrierna att ha en stabil spänningsgradient.
Elektronisk transport, protoner som pumpar och ATP får samtidigt i mitokondrierna, tack vare den protoniska motorstyrkan. PH -gradienten upprätthåller sura förhållanden i intermembran och mitokondriell matris med alkaliska förhållanden.
För varje två elektroner som överförs till O2 Cirka 10 protoner pumpas av membranet, vilket skapar en elektrokemisk gradient. Energin som är fristående i denna process produceras gradvis genom att passera elektroner genom transportkedjan.
Stadier
Energin som släpptes under oxidreduktionsreaktioner av NADH och FADH2 Den är betydligt hög (cirka 53 kcal/mol för varje elektronpar), så att den för att användas vid tillverkning av ATP -molekyler måste den gradvis produceras med passagen av elektroner genom transportörer.
Dessa är organiserade i fyra komplex belägna i det inre mitokondriella membranet. Kopplingen av dessa reaktioner till ATP -syntes utförs i ett femte komplex.
Kan tjäna dig: B -lymfocyter: egenskaper, struktur, funktioner, typerElektron transport kedja
NADH överför ett par elektroner som kommer in i komplexet i elektrontransportkedjan. Elektronerna överförs till mononukleotiden i Flavina och sedan till ubikinonet (koenzymet Q) genom en järn-sockertransportör. Denna process frigör en stor mängd energi (16,6 kcal/mol).
Ubiquinona transporterar elektroner genom membranet till komplex III. I detta komplex går elektronerna genom cytokromer B och C1 Tack vare en järnsockertransportör.
Från komplex III passerar elektroner till IV -komplexet (cytokrom C -oxidas), överförd en med cytokrom C (perifert membranprotein). I IV -komplexet passerar elektronerna genom ett par kopparjoner (CUtill2+), sedan till cytokrom ctill, Sedan till ett annat par kopparjoner (CUb2+) och från detta till cytokrom till3.
Slutligen överförs elektroner till o2 vilket är den sista acceptorn och bildar en vattenmolekyl (h2O) För varje par av elektroner. Passagen av elektroner från komplex IV till O2 Det genererar också mycket fri energi (25,8 kcal/mol).
Succinato coq -reduktas
II -komplexet (CoQ -reduktas succinat) tar emot ett par elektroner från citronsyrcykeln på grund av oxidationen av en succinatmolekyl till fumarat. Dessa elektroner överförs till modet och passerar sedan genom en järn-azufre-grupp, till Ubiquinona. Från detta koenzym går de till komplexa III och följer den tidigare rutt som beskrivs.
Energin som frigörs i elektronöverföringsreaktionen till modet räcker inte för att öka protonerna genom membranet, så att det i detta steg i kedjan inte finns någon protonisk motorkraft, och följaktligen ger FADH mindre h+ än Nadh.
Energikoppling eller transduktion
Energin som genereras i den tidigare beskrivna elektrontransportprocessen bör användas för ATP -produktion, reaktion katalyserad av ATP -syntas eller komplex enzym V. Bevarande av sådan energi kallas energikoppling, och mekanismen har varit svår att karakterisera.
Flera hypoteser har beskrivits för att beskriva denna energitransduktion. Det bäst accepterade är den kemosmotiska kopplingshypotesen, som beskrivs nedan.
Kemosmotisk koppling
Denna mekanism föreslår att den energi som används för ATP -syntes kommer från en protonisk gradient i cellmembran. Denna process ingriper i mitokondrier, kloroplaster och bakterier och är kopplad till elektrontransport.
I- och IV -komplexen av elektronisk transport fungerar som protonpumpar. Dessa lider av konformationella förändringar som gör att de kan pumpa protonerna till det intermembranala utrymmet. I IV -komplexet för varje elektronpar pumpas två protoner utanför membranet och ytterligare två kvar i matrisen som bildar h2ANTINGEN.
Ubiquinona i komplexa III accepterar protoner av komplex I och II och frigör dem utanför membranet. I- och III -komplex tillåter vardera passage av fyra protoner för varje par transporterade elektroner.
Den mitokondriella matrisen har låg koncentration av protoner och negativ elektrisk potential medan det intermembranala utrymmet presenterar de omvända förhållandena. Protonernas flöde genom detta membran innebär den elektrokemiska gradienten som lagrar den nödvändiga energin (± 5 kcal/mol av proton) för ATP -syntes.
ATP -syntes
ATP -syntetasenzymet är det femte komplexet som är involverat i oxidativ fosforylering. Ansvarar för att dra nytta av energin från den elektrokemiska lutningen för att bilda ATP.
Detta transmembraalprotein består av två komponenter: f0 och f1. Komponenten f0 Tillåter återvändande av protonerna till den mitokondriella matrisen som fungerar som en kanal och F1 katalyserar syntesen av ATP via ADP och PYo, Använda energin från nämnda retur.
Kan tjäna dig: membrantransportproteiner: funktioner och typerATP -syntesprocessen kräver en strukturell förändring i F1 och montering av komponenter f0 och f1. Translokation av protoner genom f0 Det orsakar konformationella förändringar i tre underenheter av f1, tillåter detta att fungera som en rotationsmotor och riktar bildningen av ATP.
Underenheten som ansvarar för ADP: s förening med PYo går från ett svagt tillstånd (l) till en aktiv (t). När ATP bildas passerar en andra underenhet till ett öppet tillstånd (O) som tillåter frisättning av denna molekyl. Efter att ATP släpps passerar denna underenhet från det öppna tillståndet till ett inaktivt tillstånd (L).
ADP- och P -molekylernaYo De går med i en underenhet som har gått från en stat eller staten L.
Produkter
Elektrontransportkedjan och fosforylering producerar ATP -molekyler. NADH -oxidation producerar cirka 52,12 kcal/mol (218 kJ/mol) fri energi.
Den globala reaktionen för NADH -oxidation är:
NADH+1⁄2 eller2 +H+ ↔ h2O+nad+
Överföring av elektroner från Nadh och Fadh2 Det inträffar genom flera komplex, vilket gör att förändring av fri energi ΔG ° kan delas upp i mindre "paket", som är kopplade till ATP -syntes.
Oxidationen av en NADH -molekyl genererar syntesen av tre ATP -molekyler. Medan oxidationen av en FADH -molekyl2 Den är kopplad till syntesen av två ATP.
Dessa koenzymer kommer från processerna för glykolys och citronsyracykel. För varje nedbruten glukosmolekyl slutar 36 eller 38 ATP -molekyler, beroende på platsen för cellerna. I hjärnan och skelettmuskeln 36 ATP produceras medan 38 ATP produceras i muskelvävnad.
Funktioner
Alla organismer, unicellulära och multicellulära, behöver en minsta energi i sina celler för att utföra processerna inom dem och i sin tur upprätthålla viktiga funktioner i hela kroppen.
Metaboliska processer kräver att energi ska genomföras. Det mesta av användbar energi erhålls genom nedbrytning av kolhydrater och fetter. Denna energi härstammar från den oxidativa fosforyleringsprocessen.
Oxidativ fosforyleringskontroll
ATP -användningshastigheten i cellerna, kontrollerar syntesen av samma, och i sin tur, på grund av kopplingen av oxidativ fosforylering med elektrontransportkedjan, reglerar den också i allmänhet den elektroniska transporthastigheten.
Oxidativ fosforylering har en strikt kontroll som säkerställer att ATP inte genereras snabbare än den konsumeras. Det finns vissa steg i elektrontransportprocessen och den kopplade fosforyleringen som reglerar energiproduktionshastigheten.
Koordinerad kontroll av ATP -produktion
De viktigaste energiproduktionsvägarna (cell ATP) är glykolys, cykeln med citronsyra och oxidativ fosforylering. Koordinerad kontroll av dessa tre processer reglerar ATP -syntes.
Fosforyleringskontroll med ATP -massåtgärdskvoten beror på det exakta bidraget från elektroner i transportkedjan. Detta beror i sin tur på förhållandet [nadh]/[nad+] som bevaras höjt genom verkan av glykolys och citronsyran.
Denna koordinerade kontroll utförs genom att reglera glykolysstyrningspunkter (citratinhiberad PFK) och cytrinsyran (dehydrogenaspyruvat, cutascitrat, itkitratdehydrogenas och a-zetoglutarat dehydrogenas)).
Kontroll av acceptor
IV -komplexet (cytokrom C -oxidas) är ett enzym som regleras av ett av dess substrat, det vill säga dess aktivitet styrs av den reducerade cytokromen C (C2+), som i sin tur är i balans med förhållandet mellan koncentrationerna mellan [nadh]/[nad+] och massåtgärdskvoten [ATP]/[ADP] + [PYo].
Det kan tjäna dig: ton: egenskaper och funktionerJu högre [nadh]/[nad+] och sänk [ATP]/[ADP]+[PYo], mer koncentration kommer att vara cytokrom [c2+] och större är aktiviteten för komplex IV. Detta tolkas till exempel om vi jämför organismer med olika viloaktiviteter och hög aktivitet.
Hos en individ med hög fysisk aktivitet, konsumtionen av ATP och därför dess hydrolys till ADP + PYo Det kommer att vara mycket högt, vilket genererar en skillnad i massåtgärdskvoten som orsakar en ökning av [c2+och därför en ökning av ATP -syntesen. I en vilande individ inträffar den omvända situationen.
I slutändan ökar hastigheten på oxidativ fosforylering med koncentrationen av ADP inom mitokondrierna. Denna koncentration beror på ADP-ATP-translokatorer som ansvarar för transport av adeninnukleotider och PYo Från cytosol till mitokondriell matris.
Decacoplants Agents
Oxidativ fosforylering påverkas av vissa kemiska medel, som gör att elektronisk transport kan fortsätta utan fosforylering av ADP, frikoppla produktion och bevarande av energi.
Dessa medel stimulerar mitokondria syreförbrukningshastighet i frånvaro av ADP, vilket också orsakar en ökning av ATP -hydrolys. De agerar genom att eliminera en mellanhand eller bryta ett energitillstånd från elektrontransportkedjan.
2,4-dinitrofenolen, en svag syra som passerar genom mitokondriella membranen, är ansvarig för att sprida protonsgradienten, eftersom de går med dem på den sura sidan och släpper dem på grundsidan.
Denna förening användes som en "bantningspiller" eftersom det konstaterades att den gav en ökning av andningen, därför en ökning av metabolismhastigheten och tillhörande viktminskning. Det visades emellertid att dess negativa effekt till och med kan orsaka döden.
Spridning av den protoniska gradienten producerar värme. Brun fettvävnadsceller använder frikoppling, hormonellt kontrollerade, för att producera värme. Hibernate däggdjur och nyfödda som saknar hår består av denna vävnad som tjänar dem som en slags termisk filt.
Hämmare
Hämmande föreningar eller medel förhindrar både konsumtionen av eller2 (elektronisk transport) såsom tillhörande oxidativ fosforylering. Dessa medel undviker bildandet av ATP genom användning av energi som produceras vid elektronisk transport. Därför stoppas transportkedjan eftersom sådan energiförbrukning inte ordnas.
Oligomicin antibiotika fungerar som en fosforyleringsinhibitor i många bakterier, vilket förhindrar ADP -stimulering från ATP -syntes.
Det finns också jonoforösa medel, som utgör fett -lösliga komplex med katjoner som K+ och na+, och passera genom det mitokondriella membranet med dessa katjoner. Mitokondrierna använder sedan energi som produceras i elektronisk transport för att pumpa katjoner istället för att syntetisera ATP.
Referenser
- Alberts, b., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, m., Roberts, K. & Walter, s. (2004). Essential Cell Biology. New York: Garland Science.
- Cooper, g. M., Hausman, r. OCH. & Wright, n. (2010). Cellen. (PP. 397-402). Marbán.
- Devlin, t. M. (1992). Lärobok för biokemi: Med kliniska korrelationer. John Wiley & Sons, Inc.
- Garrett, R. H., & Grisham, c. M. (2008). Biokemi. Thomson Brooks/Cole.
- Lodish, h., Darnell, J. OCH., Berk, A., Kaiser, c. TILL., Krieger, m., Scott, m. P., & Matsudaira, s. (2008). Mollecular cellbiologi. Macmillan.
- Nelson, D. L., & Cox, M. M. (2006). Lehninger principer för biokemi Fjärde upplagan. Ed omega. Barcelona.
- Voet, D., & Voet, J. G. (2006). Biokemi. Ed. Pan -amerikansk medicin.
- « Euglenophyta -egenskaper, reproduktion, näring, klassificering
- Glukosides utbildning, funktion och typer/grupper »

