Aluminium fosfuro (AIP) struktur, egenskaper, användningar, risker

- 4389
- 580
- Johan Johansson
han aluminiumfosfid Det är en oorganisk förening bildad av en aluminiumatom (AL) och en fosforatom (P). Dess kemiska formel ALP. Det är ett mörkgrått fast ämne eller, om det är väldigt rent, gult. Det är en extremt giftig förening för levande varelser.
Aluminiumfosfuro reagerar med fukt för att bilda fosfin eller fosfano -pH3, vilket är en giftig gas. Av denna anledning bör ALP inte kontakta vatten. Reagerar starkt med alkaliska syror och lösningar.
 Aluminiumfosfid. همان [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons.
Aluminiumfosfid. همان [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons. Det användes tidigare för att eliminera skadedjur som insekter och gnagare på platser där spannmålskorn och andra jordbruksprodukter lagrades. På grund av dess höga fara har det emellertid förbjudits i de flesta länder i världen.
För närvarande undersöks dess användbarhet inom elektronikområdet teoretiskt genom datorer som beräknar möjligheten att erhålla halvledar -ALP -nanorör, det vill säga extremt små rör som endast kan överföra el under vissa förhållanden.
Aluminiumfosfuro är en mycket farlig förening, den måste manipuleras med säkerhetsredskap som handskar, linser, andningsutrustning och skyddskläder.
[TOC]
Strukturera
ALP -aluminiumfosfuro bildas av föreningen av en aluminiumatom vid fosforpatomen P. Länken mellan de två är kovalent och trippel, därför är den mycket stark.
Aluminium i ALP har ett oxidationstillstånd på +3 och fosforet har en valens av -3.
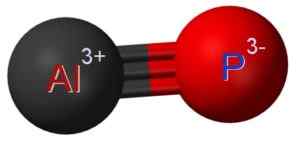 Aluminiumfosfurostruktur där du kan se trippelförbindelsen mellan aluminium (AL) och fosfor (P) atomer (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Aluminiumfosfurostruktur där du kan se trippelförbindelsen mellan aluminium (AL) och fosfor (P) atomer (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Nomenklatur
- Aluminiumfosfid
Egenskaper
Fysiskt tillstånd
Mörkgrå kristallint fast eller mörkgul. Kubikkristaller.
Molekylvikt
57,9553 g/mol
Smältpunkt
2550 ºC
Densitet
2,40 g/cm3 vid 25 ° C
Löslighet
Det sönderdelas i vatten.
Kemiska egenskaper
Reagerar med fukt för att ge fosfin eller fosfan -pH3 vilket är en brandfarlig och giftig förening. Fosfin eller fosfaan.
Kan tjäna dig: gadolinio: struktur, egenskaper, erhållning, användningAluminiumfosfuroreaktionen med vatten är som följer:
Aluminiumfosfuro + vatten → aluminiumhydroxid + fosfin
Alp + 3 h2O → till (OH)3 + PH3↑
Kommersiella presentationer har aluminiumkarbonat till2(Co3)3 För att förhindra självriktning av fosfin som uppstår när ALP kommer i kontakt med luftens fukt.
ALP är stabil när den är torr. Reagerar våldsamt med alkaliska syror och lösningar.
ALP -aluminiumfosfuro smälter inte, och inte sublimal eller sönderdelas termiskt vid temperaturer så höga som 1000 ° C. Även vid denna temperatur är ångtrycket mycket lågt, det vill säga det inte avdunstas vid den temperaturen.
När de värms upp till hans sönderdelning avger giftiga fosforoxider. I kontakt med metaller kan du avge brandfarliga vätgaser h2.
Andra egenskaper
När det är rent visar det en gulaktig färg, när den blandas med rester av beredningsreaktionen presenterar färg från grå till svart.
Dess låga volatilitet utesluter att den har en lukt, så lukten av vitlök som ibland avger beror på fosfinens pH3 som bildas i närvaro av fukt.
Erhållande
Aluminiumfosfuro kan erhållas genom att värma en blandning av aluminium (Al) metallpulver och det röda fosforelementet (P).
På grund av affiniteten hos fosfor (P) med syre (eller2) och den för aluminium (Al) med syre och kväve (N2) Måste reaktionen genomföras i fri atmosfär av dessa gaser, såsom väteatmosfär (h2) eller naturgas.
Reaktionen börjar snabbt värma ett område i blandningen tills reaktionen börjar, vilket är exoterm (värme inträffar under samma). Från det ögonblicket fortsätter reaktionen snabbt.
Aluminium + fosfor → aluminiumfosfuro
4 till + p4 → 4 ALP
Ansökningar
Vid eliminering av skadedjur (avbruten användning)
Aluminiumfosfuro användes tidigare som insektsmedel och som gnagare utrotare. Men även om det har förbjudits av dess toxicitet, används det fortfarande i vissa delar av världen.
Kan tjäna dig: .Stearic Acid (CH3 (CH2) 16COOH): Struktur, egenskaper, användningarDet används för rökning i stängda utrymmen där bearbetade eller obearbetade livsmedelsprodukter finns (som spannmål), mat för djur- och icke -matprodukter.
Målet är att kontrollera insekter och gnagare som attackerar lagrade artiklar, oavsett om det är ätbara eller inte.
Det tillåter kontroll av gnagare och insekter i icke -domestika, jordbruks- eller icke -jordbruksområden, rökning utomhus eller i deras hålor och bon för att förhindra att vissa sjukdomar överförs.
 Råttor och möss är skadedjur som attackerar spannmålslagringsplatser. För några år sedan utkämpades de med aluminiumfosfuro. Författare: Andreas n. Källa: Pixabay.
Råttor och möss är skadedjur som attackerar spannmålslagringsplatser. För några år sedan utkämpades de med aluminiumfosfuro. Författare: Andreas n. Källa: Pixabay.  Gnagarna kontrollerades genom att placera aluminiumfosfuro i deras hålor. Författare: Photo-Rabe. Källa: Pixabay.
Gnagarna kontrollerades genom att placera aluminiumfosfuro i deras hålor. Författare: Photo-Rabe. Källa: Pixabay. Dess användningsform består i exponeringen av ALP i luft eller fukt, eftersom fosfin eller fosfas -pH frigörs3 som genererar skador på många pestorgan för att eliminera.
 Insekter eliminerades också med ALP -aluminiumfosfuro. Författare: Michael Power. Källa: Unspash.
Insekter eliminerades också med ALP -aluminiumfosfuro. Författare: Michael Power. Källa: Unspash. I andra applikationer
ALP -aluminiumfosfuro används som en källa för fosfin eller fosfano -pH3 och används i halvledarforskning.
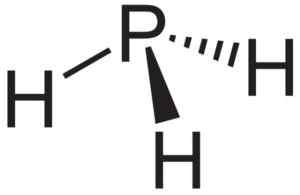 Fosphaano eller fosfin pH3, Förening som bildas när ALP -aluminiumfosfuro kommer i kontakt med vatten. Neuroteker [Public Domain]. Källa: Wikimedia Commons.
Fosphaano eller fosfin pH3, Förening som bildas när ALP -aluminiumfosfuro kommer i kontakt med vatten. Neuroteker [Public Domain]. Källa: Wikimedia Commons. Teoretisk forskning om ALP -nanorör
Teoretiska studier har genomförts vid bildningen av ALP -aluminiumfosfuro -nanorör. Nanorör är mycket små och mycket tunna cylindrar som endast kan synas med ett elektroniskt mikroskop.
ALP -nanorör med bor
Teoretiska studier som genomförts genom beräkningsberäkningar visar att föroreningar som kan läggas till nanorören för ALP kan förändra dessa teoretiska egenskaper hos dessa.
Till exempel uppskattas att tillsats av boratomer (B) till ALP -nanorör kan förvandla dem till typ halvledare-p. En halvledare är ett material som uppträder som en elektricitetsledare eller som en isolerande beroende på det elektriska fältet som det utsätts för.
Kan tjäna dig: Plasmatillstånd: Egenskaper, typer och exempelOch en halvledare-p Det är när materialet läggs till föroreningar, i detta fall är ALP utgångsmaterialet och boratomerna skulle vara föroreningar. Halvledare är användbara för elektronikapplikationer.
ALP -nanorör med förändrad struktur
Vissa forskare har genomfört beräkningar för att bestämma effekten av att ändra strukturen i det kristallina nätverket i nanorören i ALP från hexagonal till oktaedral.
De fann att manipulationen av den kristallina nätverksstrukturen kunde användas för att justera konduktiviteten och reaktiviteten hos ALP -nanorör och utforma dem så att de är användbara för elektronik och optiska applikationer.
Risker
Kontakt med aluminiumfosfuro kan irritera huden, ögonen och slemhinnan. Om det intas eller inhaleras är det giftigt. Det kan absorberas genom huden med toxiska effekter.
Om ALP kommer i kontakt med vatten reagerar och fosfinform eller fosfan pH3 vilket är extremt brandfarligt eftersom det brinner i kontakt med luften. Därför kan det utnyttja. Dessutom orsakar fosfin döden av människor och djur.
Eftersom en ekonomisk bekämpningsmedel är aluminiumfosfuro är dess användning en vanlig orsak till människors förgiftning och innebär en hög dödlighet.
 Aluminiumfosfuro är extremt farligt. Författare: OpenClipart-Vectors. Källa: Pixabay.
Aluminiumfosfuro är extremt farligt. Författare: OpenClipart-Vectors. Källa: Pixabay. Reagerar med slemhinnans fukt och med HCL -saltsyran i magen och bildar den mycket toxiska fosfan -pH -gasen3. Därför bildas fosfin genom inandning och intag i kroppen med dödliga effekter.
Dess intag orsakar blödning av mag -tarmkanalen, hjärt -kärlskollaps, neuropsykiatriska störningar, andningsfel och njursvikt på några timmar.
ALP är mycket giftigt för alla mark- och vattenlevande djur.
Referenser
- ELLER.S. National Library of Medicine. (2019). Fosfidaluminium. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Sjögren, f. et al. (2007). Aluminium. Andra aluminiumföreningar. I handbok om toxikologin för metaller (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Gupta, r.C. och Crissman, J.W. (2013). Säkerhetsbedömning inklusive aktuella och nya frågor inom toxikologipatologi. Mänsklig risk. I Haschek och Rousseaux's Handbook of Toxicology Pathology (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Vit, W.OCH. och Bushey, till.H. (1944). Aluminiumfhosfid - beredning och komposition. Journal of the American Chemical Society 1944, 66, 10, 1666-1672. Återhämtat sig från pubar.ACS.org.
- Mirzaei, Maryam och Mirzaei, Mahmoud. (2011). En teoretisk studie av boron-due aluminiumfosfid nanorör. Computational and Theoretical Chemistry 963 (2011) 294-297. Återhämtat sig från Scientedirect.com.
- Takahashi, l. Och Takahashi, K. (2018). Stämma in den elektroniska strukturen i en aluminiumfosfid nanorör Detta. ACS Appl. Nano mater. 2018, 1, 501-504. Återhämtat sig från pubar.ACS.org.
- Gupta, s.K. (2016). Toxiska effekter av pesicider (agrokemikalier). Fosfidaluminium. I medel för toxikologi. Återhämtat sig från Scientedirect.com.
- « Rektangulära koordinater exempel och övningar löst
- Grad av ett polynom hur det bestäms, exempel och övningar »

