Minsta formel Hur man tar bort minsta formel, exempel och övningar
- 2754
- 586
- PhD. Lennart Johansson
De Minsta eller empiriska formel Det är ett uttryck för andelen där atomerna i de olika elementen som bildar en kemisk förening finns. Minsta formel är därför den enklaste representationen av en kemisk förening. Till detta beror på "minimum".
Minsta formel uttrycker inte atomnumren för de olika elementen som bildar en kemisk förening; men andelen i vilken dessa atomer kombineras för att generera den kemiska föreningen.
 Denna minimala formel avslöjar knappt att föreningen har samma mängder kol och syreatomer och dubbla väteatomer. Källa: Gabriel Bolívar.
Denna minimala formel avslöjar knappt att föreningen har samma mängder kol och syreatomer och dubbla väteatomer. Källa: Gabriel Bolívar. Minsta formel kallas också empirisk formel, eftersom den erhålls från experiment; det vill säga det är relaterat till erfarenhet. Experimentell observation tillåtet att dra slutsatsen att två väteatomer kombineras med en väteatom för att bilda vatten (h2ANTINGEN).
I många fall sammanfaller minsta formel med molekylformeln. I molekylen visas de verkliga siffrorna på de olika elementen som bildar en kemisk förening; Sådant är fallet, till exempel svavelsyra (h2Sw4).
Men i andra fall finns det ingen sammanfall av minsta formel och molekylformeln; Sådan är fallet med bensen: Minsta formel är CH, medan dess molekylformel är C6H6.
[TOC]
Hur man får minsta formel?
Första steget
Hitta gram för varje element som finns i föreningen. Som vanligtvis uttrycks som en procentandel av förenings massa måste en enkel beräkning göras för omvandlingen av massmassaprocent av elementen.
Andra steg
Det relativa antalet atomer i de olika elementen som bildar den kemiska föreningen erhålls. För att göra detta är massan för varje element uppdelad, uttryckt i gram, mellan dess atommassa.
Vissa författare föredrar att kalla det relativa antalet atomer, till exempel antalet mol atomer i elementen som ingår i den kemiska föreningen.
Kan tjäna dig: butanal: struktur, egenskaper, användningar och riskerTredje steg
Erhålla minsta andel, uttryckt i hela antal, av var och en av atomerna som finns i den kemiska föreningen.
För att hitta dessa värden delas det relativa antalet för varje atom i föreningen mellan det relativa numeriska värdet som en atom i den kemiska föreningen.
I händelse av att värdet på den minsta andelen av en atom inte är ett heltal utan decimaler, måste alla värden på minsta andel med ett antal multipliceras; På detta sätt, att det gör att alla värden på minsta andel är hela siffror.
Till exempel, om värdet på den minsta andelen av en atom i den kemiska föreningen är 2.5, måste multipliceras Allt Värdena på minsta andel av var och en av atomerna som finns med 2. Således kommer alla värden på minsta andel bara att vara hela siffror.
Fjärde steget
Skriv minsta föreningsformel. Värdena för minsta andel för atomerna i de olika elementen kommer att placeras som abonnemang av de kemiska symbolerna för element för att skriva minsta formel.
Exempel på minsta formel
Vatten och koldioxid
De flesta kemiska föreningar har formler som samtidigt är minsta och molekylära formler. Således vattenformeln (h2O) är en minimal formel; Men det är också en molekylformel. Detsamma gäller för koldioxidformeln (CO2).
Grundläggande och sura oxider
Grundoxider och syror är kemiska föreningar som har kemiska formler, såvida inte förutom undantag som är både minimala och molekylära formler. Samma situation inträffar med hydroxider och syror, med undantag för vissa karboxylsyror.
Kan tjäna dig: Acetonitrile (C2H3N)Ättiksyra
Karboxylsyror som har ett par antal kolatomer i sin sammansättning är separat, en minimal formel och en molekylformel. Ättiksyra har till exempel en molekylformel (c2H4ANTINGEN2); Men det presenterar också en minimal formel (Cho2ANTINGEN).
Smörsyra
Också butyrinsyra har en molekylformel (c4H8ANTINGEN2) och en minsta formel (c2H4ANTINGEN).
Etylenglykol
Andra organiska föreningar har de två typerna av kemiska formler; Sådan är fallet med etylenglykol, som har en molekylformel (c2H6ANTINGEN2) och en minsta formel (Cho3ANTINGEN).
Bensen
Bensen, en aromatisk förening, har en molekylformel (c6H6) och en minsta formel (CH).
Glukos
Glukos har en molekylformel (c6H12ANTINGEN6) och en minsta formel (Cho2ANTINGEN).
Löst övningar
- Övning 1
Etylenglykol är en förening som används som en frostskydd, har en molekylvikt av 62,1 g/mol och en nästa massprocentkomposition:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Första steget
Uttrycka massprocenten av elementen i deras massor i gram. För att göra detta tas molekylvikten för etilenglicol som referens. Om detta är 62,1 gram per mol består 38% av samma kol. Och så vidare med de andra elementen:
Kolmassa = 62,1 g · (38/100)
= 23,6 g
Vätmassa = 62,1 g · (9,7/100)
= 6,024 g
Syremassa = 62,1 g · (51,16/100)
= 31,77 g
Andra steg
Beräkna det relativa antalet för varje nuvarande atom (nra) eller antalet mol för varje atom. För att göra detta delas massan för varje kemiskt element med dess atommassa.
NRA (C) = 23,6 g / 12 g
= 1,97
Det kan avrundas till 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Det kan avrundas vid 6.
NRA (O) = 31,77 g /16 g
= 1 985
Det kan avrundas till 2.
Tredje steg
Beräkna minsta andel av hela antalet element i föreningen (PMNE). För att göra detta delas var och en av värdena för atomrelativa siffror (NRA) med det lägsta värdet av detta. I det här fallet 2.
Det kan tjäna dig: propansyraPmne (c) = 2/2
= 1
Pmne (h) = 6/2
= 3
Pmne (o) = 2/2
= 1
Fjärde steget
Skriv den minimala formeln för etylenglykol:
Ch3ANTINGEN
Som man kan se är värdena som erhållits i steg 3 abonnemanget för sammansatta element.
- Övning 2
Ättiksyra har en molekylvikt av 60 g/mol och en efterföljande massaprocentkomposition:
C: 40 %
H: 6,67 %
O: 53,33 %
Få minimiföreningsformeln.
Första steget
Förvandla massprocenten av elementen till deras massor uttryckta i gram:
Kolmassa = 60 g · (40/100)
= 24 g
Vätmassa = 60 g · (6,67/100)
= 4 g
Syremassa = 60 g · (53,33/100)
= 32 g
Andra steg
Beräkna de relativa antalet av atomerna (NRA) för föreningen. För att göra detta är massorna av elementen uppdelade mellan deras atommassor:
NRA (C) = 24 g / 12 g
= 2
Nra (h) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Tredje steg
Få minsta andel av hela antalet element i föreningen (PMNE). För att göra detta är NRA -värdena för elementen uppdelade mellan det lägre värdet på NRA som presenterar ett element:
Pmne (c) = 2/2
= 1
Pmne (h) = 4/2
= 2
Pmne (o) = 2/2
= 1
Fjärde steget
Skriv den minimala formeln för ättiksyra:
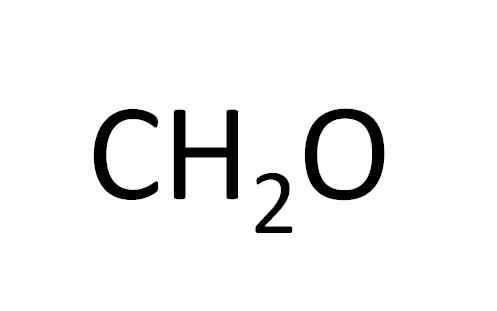
Ch2ANTINGEN
Föreningsbeskrivningarna är de värden som erhållits från PMNE.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (27 augusti 2019). Empirisk formel: Definition och exempel. Återhämtat sig från: tankco.com
- Wikipedia. (2020). Empirisk formel. Hämtad från: i.Wikipedia.org
- Kemi librettexts. (3 juli 2019). Empiriska beräkningsformler för föreningar. Återhämtad från: kem.Librettexts.org
- Nicola McDougal. (2020). Empirisk formel: Definition, steg och exempel. Studie. Återhämtat sig från: studie.com
- « Irreversibla reaktionsegenskaper och exempel
- Molekylär formel Hur man får ut det, exempel och övningar »

