Londonstyrkor
- 1234
- 281
- Anders Larsson
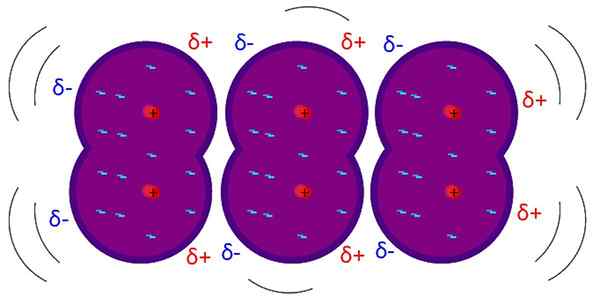
 Londonstyrkor är intermolekylära svaga interaktioner. Källa: Riccardo Rovinetti, Wikimedia Commons
Londonstyrkor är intermolekylära svaga interaktioner. Källa: Riccardo Rovinetti, Wikimedia Commons Vad är Londons styrkor?
De Londonstyrkor, London-spridningskrafter eller inducerade dipolinteraktioner är den svagaste typen av intermolekylära interaktioner. Hans namn beror på bidrag från teoretisk fysiker Fritz London (1900-1954) och hans studier inom kvantfysikområdet.
Londons styrkor förklarar hur molekyler interagerar vars strukturer och atomer gör bildandet av en permanent dipol; det vill säga i grunden gäller apolära molekyler eller atomer isolerade från ädla gaser.
Till skillnad från de andra Van der Waals -styrkorna kräver detta extremt korta avstånd.
Egenskaper för Londons styrkor
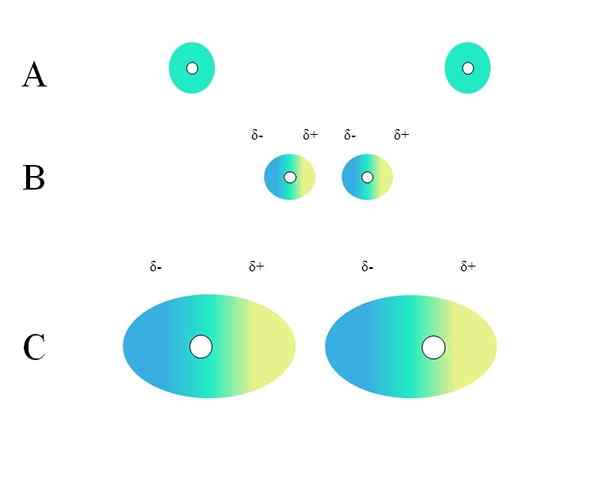 Distribution av homogena laddningar. Källa: Gabriel Bolívar
Distribution av homogena laddningar. Källa: Gabriel Bolívar Vilka egenskaper bör en molekyl ha så att den kan interagera genom London -krafter? Svaret är att vem som helst kan göra det, men när det finns ett permanent dipolmoment, dominerar dipol-dipolo-interaktioner snarare än spridningen, vilket bidrar mycket lite till de fysiska naturen hos ämnena.
I strukturer där det inte finns några mycket elektronegativa atomer eller vars elektrostatiska belastningsfördelning är homogen, finns det inget slut eller region som kan betraktas som rik (Δ-) eller dålig (Δ+) i elektroner.
I dessa fall måste andra typer av krafter ingripa, eller på annat sätt kan dessa föreningar bara existera i en gasfas, oavsett även trycket eller temperaturförhållandena som arbetar på dem.
Homogen belastningsfördelning
Två isolerade atomer, såsom neon eller argon, har en homogen belastningsfördelning. Detta kan ses i en överlägsen bild. Vita cirklar i mitten representerar kärnorna, för atomer eller molekylskelett, för molekyler. Denna lastfördelning kan betraktas som ett moln av gröna elektroner.
Varför uppfyller ädla gaser denna homogenitet? Eftersom de har sitt elektroniska lager helt fullt, så måste deras elektroner teoretiskt känna lika attraktionen hos kärnan i alla orbitaler.
Å andra sidan, för andra gaser såsom atomiskt syre (O), är dess skikt ofullständigt (som observeras i sin elektroniska konfiguration) och tvingar den att bilda den diatomiska molekylen eller2 För att kompensera för denna brist.
Gröna cirklar av en kan också vara molekyler, små eller stora. Dess bana elektroner moln runt alla atomer som gör det, särskilt om det mest elektronegativa. Runt dessa atomer kommer molnet att koncentreras och kommer att vara mer negativa, medan andra atomer kommer att ha en elektronisk brist.
Kan tjäna dig: icke -polär kovalent bindningDetta moln är emellertid inte statisk utan dynamisk, så vid någon tidpunkt kommer korta regioner Δ- och Δ+att bildas, och ett fenomen som kallas kommer att inträffa Polarisering.
Polariserbarhet
I det gröna molnet indikerar en homogen negativ belastningsfördelning. Den positiva attraktionskraften som utövas av kärnan kan emellertid variera på elektroner. Detta orsakar en molndeformation och skapar således 5-regioner, blå och 5+, gul.
Detta plötsliga dipolmoment i atomen eller molekylen kan snedvrida ett angränsande elektroniskt moln; Med andra ord inducerar det en plötslig dipol över sin granne (B, överlägsen bild).
Detta beror på att Δ-regionen stör det angränsande molnet, dess elektroner känner elektrostatisk avstötning och är orienterade i motsatt pol, och visas 5+.
Notera hur positiva poler är i linje med negativerna, precis som molekyler med permanenta dipolmoment. Ju mer omfattande det elektroniska molnet, desto svårare kommer kärnan att hålla det homogent i rymden; Och dessutom kommer det att vara deformationen av den, vilket kan ses i c.
Därför är små atomer och molekyler mer osannolikt att polariseras av någon partikel i deras omgivningar. Ett exempel för denna situation illustreras av den lilla vätemolekylen, h2.
Att kondensera, eller ännu mer, kristalliserar, behöver orimligt tryck för att tvinga sina molekyler att fysiskt interagera.
Är omvänt proportionell mot avstånd
Även om omedelbara dipoler bildas som inducerar andra runt dem, räcker de inte för att hålla atomer eller molekyler tillsammans.
I B finns det ett avstånd d som skiljer de två molnen och deras två kärnor. Så att båda dipolerna kan förbli en tid som övervägs, detta avstånd d Det måste vara väldigt litet.
Detta tillstånd måste uppfyllas, ett väsentligt kännetecken för London -styrkorna (kom ihåg kardborrstängning), så att en ökänd effekt på de fysiska egenskaperna hos saken tillförs.
En gång d vara liten, kärnan i vänster i B kommer att börja locka den blå regionen Δ- av angränsande atom eller molekyl. Detta kommer ytterligare att deformera molnet, vilket kan ses i C (kärnan är inte längre i mitten utan till höger).
Kan tjäna dig: alkenesSedan finns det en punkt där båda molnen berör och "studsar", men till en långsamhet tillräckligt för att ha dem tillsammans med en tid.
Därför är Londons styrkor omvänt proportionella mot avstånd d. Faktum är att faktorn är lika med d7, Så en minimal variation av avståndet mellan både atomer eller molekyler kommer att försvaga eller stärka spridningen av London.
Det är direkt proportionellt mot molekylmassan
Hur man ökar molnstorleken så att de lättare är polariserade? Tillägg av elektroner, och för det måste kärnan ha fler protoner och neutroner och därmed öka atommassan; eller tillsätta atomer till molekylens skelett, som i sin tur skulle öka dess molekylmassa.
På detta sätt skulle kärnorna eller molekylskelettet vara mindre benägna att hålla det elektroniska molnet hela sin tid. Därför, ju större de gröna cirklarna som beaktas i A, B och C, desto mer polariserbara kommer de att vara och större kommer också att vara deras interaktioner från London Forces.
Denna effekt observeras tydligt mellan B och C, och det kan vara ännu mer om cirklarna hade större diameter. Detta resonemang är nyckeln till att förklara de fysiska egenskaperna hos många föreningar beroende på deras molekylmassor.
Exempel på London -styrkor
 Naturligt exempel på Londons styrkor: Gecos ben
Naturligt exempel på Londons styrkor: Gecos ben I naturen
I det dagliga livet finns det otaliga exempel på Londons spridningskrafter utan att behöva våga, i första hand den mikroskopiska världen.
Ett av de vanligaste och överraskande exemplen finns i benen på reptiler kända som GECOS (överlägsen bild) och i många insekter (även i Spiderman).
I benen har de några kuddar som tusentals små filament sticker ut. På bilden kan du se en geco som poserar i en sten sluttning. För att uppnå detta använder det de intermolekylära krafterna mellan berget och filamenten på deras ben.
Var och en av dessa filament interagerar svagt med ytan genom vilken den lilla reptilen. GECO: erna kan också klättra smidiga och perfekta ytor som kristallerna.
Det kan tjäna dig: kaliumnitrit (KNO2): Struktur, egenskaper och användningarSlutna
Alkanerna är mättade kolväten som också interagerar av London Forces. Dess molekylstrukturer består helt enkelt av kol och hydrogener förenade med enkla bindningar. Eftersom skillnaden i elektronegativitet mellan C och H är mycket liten är de apolära föreningar.
Således metan, Cho4, Det minsta kolvätet av alla, kokar vid -161.7: e c. När C och H tillsätts till skelettet erhålls andra alkaner med högre molekylmassor.
På detta sätt uppstår etan (-88.6: e c), butan (-0.5: e c) och oktanen (125.7: e c). Observera hur deras kokpunkter ökar när alkanerna blir tyngre.
Detta beror på att deras elektroniska moln är mer polariserbara och deras strukturer har ett större ytligt område, som ökar kontakten mellan deras molekyler.
Oktanen, även om det är en apolär förening, har en kokpunkt större än vatten.
Halogener och gaser
Londons styrkor finns också i många gasformiga ämnen. Till exempel N -molekyler2, H2, Co2, F2, Kli2 Och alla ädla gaser interagerar genom dessa krafter, eftersom de har homogen elektrostatisk distribution, som kan drabbas av ögonblicksbild och ge upphov till polarisationer.
De ädla gaserna är han (helium), neon (neon), AR (Argon), KR (Kripton), Xe (Xenon) och RN (Radon). Från vänster till höger ökar deras kokpunkter med ökningen av atommassorna: -269, -246, -186, -152, -108 och -62 ºC.
Halogener interagerar också genom dessa krafter. Fluor är en gas vid rumstemperatur, precis som klor. Bromen, med större atommassa, är i normala förhållanden som en rödaktig vätska, och jod, för att avsluta, bildar ett lila fast ämne som snabbt sublimerar eftersom den är tyngre än de andra halogenerna.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan.). Cengage Learning, s 452-455.
- Angeles Méndez. (22 maj 2012). Dispersionskrafter (från London). Återhämtat sig från: kemi.Laguia2000.com
- London Dispersion Forces. Återhämtad från: kem.Purdu.Edu
- Helmestine, Anne Marie, PH.D. (22 juni 2018). 3 typer av intermolekylära krafter. Återhämtat sig från: tankco.com
- Ryan Ilagan & Gary L Bertrand. London -spridningsinteraktioner. Taget från: Chem.Librettexts.org
- Kempils norials. Londonstyrkor. Återhämtad från: kem.Vagga.Edu
- Kamereon. (22 maj 2013). Salamanqueas: Geco och styrkorna från Van der Waals. Återhämtat sig från: almabiologica.com

