Hydracy
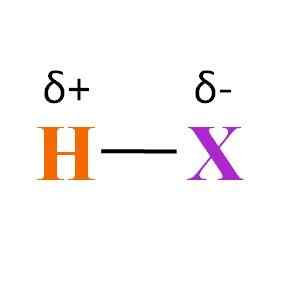
- 2151
- 336
- Lars Eriksson
Vad är Hydrace?
De Hydracy, O binära syror, är föreningar upplösta i vatten som består av väte och ett icke -metalliskt element: vätehalider. Dess allmänna kemiska formel kan uttryckas som HX, där H är väteatomen och x det icke -metalliska elementet.
X kan tillhöra grupp 17, halogener eller elementen i grupp 16 utan att inkludera syre. Till skillnad från oxoacider saknar hydracider syre. Eftersom hydraceider är kovalenta eller molekylära föreningar måste H-X-länken övervägas. Detta är av stor betydelse och definierar egenskaperna hos varje hydracy.
H-X-länk
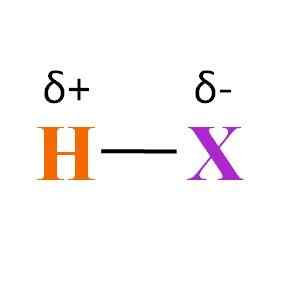 Allmän kemisk formel för en hydracy. Källa: Gabriel Bolívar
Allmän kemisk formel för en hydracy. Källa: Gabriel Bolívar Vad kan sägas om H-X-länken? Som framgår av den överlägsna bilden finns det en permanent dipolmomentprodukt av de olika elektronegativiteterna mellan H och X. Eftersom X vanligtvis är mer elektronegativ än H, lockar den sitt elektroniska moln och slutar med en negativ partiell belastning 5-.
Istället h, när man ger en del av sin elektroniska densitet till x, slutar med en positiv partiell belastning 5+. Ju mer negativ Δ-, desto rikast i elektroner kommer att vara x och desto större är den elektroniska bristen på H. Beroende på vilket element som är x kan därför en hydcens vara mer eller mindre polärt.
Bilden visar också hydracidernas struktur. H-X är en linjär molekyl som kan interagera med en annan i ett av dess ändar. Ju mer polar det är HX, dess molekyler kommer att interagera med större kraft eller affinitet. Som ett resultat kommer dess kokande eller fusionspunkter att öka.
H-X-H-X-interaktioner förblir dock tillräckligt svaga för att orsaka en solid hydrace. Därför är undervillkor för tryck och omgivningstemperatur gasformiga ämnen; förutom HF, som avdunstar över 20 ° C.
Därför att? Eftersom HF kan bilda starka vätebroar. Medan andra hydraceider, vars icke -metalliska element är mindre elektronegativa, knappt kan vara i en vätskefas under 0 ° C. HCl till exempel koka vid -85 ° C ungefär.
Är hydassyror ämnen? Svaret är i den positiva partiella belastningen Δ+ på väteatomen. Om 5+ är mycket stor eller den mycket svaga H-X-bindningen, kommer Hx att vara en stark syra, som är fallet med alla halogenhydracener, när deras respektive halogenider har upplösts i vatten.
Hydraces egenskaper
Fysisk
Genomskinliga lösningar
Synligt är alla hydracider transparenta lösningar, eftersom HX är mycket lösliga i vatten. De kan ha gulaktiga toner enligt upplösta HX -koncentrationer.
De röker
Detta innebär att de avger täta, frätande och irriterande ångor (några av dem är till och med illamående). Detta beror på att HX -molekyler är mycket flyktiga och interagerar med vattenånga som omger lösningarna. Dessutom är HX i sina vattenfria former gasformiga föreningar.
De är elledare
Hydracy är bra elledare. Även om Hx är gasformiga arter till atmosfäriska förhållanden, när de löses upp i vatten släpper de joner (h+X-), som tillåter passagen av elektrisk ström.
Kan tjäna dig: termodynamiska processerKokpunkterna är högre än för deras vattenfria former
Det vill säga HX (AC), som betecknar hydracy, kokar vid temperaturer högre än Hx (G). Till exempel väteklorid, HCl (g), kokar vid -85 ° C, men hydaklorsyra, dess hydracy, cirka 48 ° C.
Därför att? Eftersom HX -gasformiga molekyler är omgiven av vatten. Bland dem kan två typer av interaktioner uppstå samtidigt: Hx - H -broar2Eller - hx, eller jonlösning, h3ANTINGEN+(Ac) och x-(Ac). Detta faktum är direkt relaterat till de kemiska egenskaperna hos Hydrace.
Kemikalier
Hydracider är mycket sura lösningar, så de har sura protoner h3ANTINGEN+ Finns för att reagera med andra ämnen.
Var uppstår H3ANTINGEN+? Av väteatomen med positiv partiell belastning Δ+, som dissocierar i vatten och hamnar kovalent i en vattenmolekyl:
Hx (ac) + h2O (l) x-(Ac) + h3ANTINGEN+(Ac)
Observera att ekvationen motsvarar en reaktion som skapar en balans. När bildandet av x-(Ac) + h3ANTINGEN+(AC) är termodynamiskt mycket gynnad, HX kommer att släppa sin vattenproton till vatten; Och sedan detta, med H3ANTINGEN+ Som den nya "bäraren" kan du reagera med en annan förening, även om den senare inte är en stark bas.
Ovanstående förklarar syraegenskaperna hos Hydrace. Detta händer för allt HX upplöst i vatten; Men vissa genererar fler syralösningar än andra. För vad är det här? Orsakerna kan vara mycket komplicerade. Inte alla HX (AC) gynnar den tidigare balansen till höger, det vill säga mot x-(Ac) + h3ANTINGEN+(Ac).
Aciditet
Och undantaget observeras i fluorhorisk syra, HF (AC). Fluor är mycket elektronegativ, därför förkortar avståndet till H-X-länken, stärker den framför sitt brott genom vattenåtgärder.
På samma sätt har H-F-länken mycket bättre överlappning av atomradioskäl. Å andra sidan är H-CL, H-BR- eller H-I-länkarna svagare och tenderar att dissociera helt i vattnet, så att det bryts med balansen ovanför ovan.
Detta beror på att de andra halogenerna eller kalfogerna (svavel, till exempel), har större atomradio och därför mer skrymmande orbitaler. Följaktligen presenterar H-X-länken den fattigaste omloppet som X är större, vilket i sin tur har en syrakraft när de är i kontakt med vatten.
På detta sätt är den minskande ordningen för surhet för halogenhydracider som följer: HF< HCl I sina vattenfria former, HX (g), bör de nämnas som dikterat för vätehalider: tillägg av suffixet -uroxe I slutet av deras namn. Till exempel består HI (g) av en halogenid (eller hydrid) bildad av väte och jod, därför är dess namn: yoduroxe väte. Eftersom vanligtvis icke -metaller är mer elektronegativa än väte har det ett oxidationsnummer +1. I NAH har å andra sidan väte ett oxidationsnummer -1. Detta är ett annat indirekt sätt att differentiera molekylära hydrorer från halogen eller vätehalider från andra föreningar. När Hx (g) mellan kontakt med vatten representeras den som HX (AC) och sedan har hydracy. För att utse Hydracy, HX (AC), måste suffixet bytas ut -uroxe av dess vattenfria former av suffixet -Vatten. Och bör nämnas som syror först. För det föregående exemplet namnges HI (AC) som: Yod AcidVatten. Hydraceider kan bildas genom enkel upplösning av deras motsvarande vätehalogenider i vatten. Detta kan representeras med följande kemiska ekvation: Hx (g) => hx (ac) Hx (g) är mycket löslig i vatten, så det finns ingen balans mellan löslighet, till skillnad från dess joniska dissociation för att frigöra syraprotoner. Det finns emellertid en syntetisk metod som föredras eftersom den använder som råmaterialsalter eller mineraler, vilket löser dem vid låga temperaturer med starka syror. Om bordsalt, NaCl, upplöses med koncentrerad svavelsyra, inträffar följande reaktion: NaCl (s) +h2Sw4(ac) => hcl (ac) +nahso4(Ac) Svavelsyran donerar en av dess syreprotoner till anjonklorid CL-, därmed förvandla den till saltsyra. Från denna blandning kan undkomma väteklorid, HCl (g), eftersom den är mycket flyktig, särskilt om dess koncentration i vattnet är mycket hög. Det andra saltet som produceras är natriumsyra sulfat, nahso4. Ett annat sätt att producera det är att ersätta svavelsyra med koncentrerad fosforsyra: NaCl (s) + h3Po4(ac) => hcl (ac) + nah2Po4(Ac) H3Po4 reagerar på samma sätt som h2Sw4, producerar saltsyra och natriumdasfosfat. NaCl är källan till Cl -anjonen-, så att för att syntetisera de andra hydracests, salter eller mineraler som innehåller f behövs-, Bras-, Yo-, S2-, etc. Men användningen av H2Sw4 eller h3Po4 Det beror på dess oxidativa kraft. H2Sw4 Det är ett mycket starkt oxiderande medel, så att oxiderar till och med BR- och jag- till dess molekylära former br2 och jag2; Den första är en rödaktig vätska, och den andra en lila fast ämne. Därför h3Po4 representerar det föredragna alternativet i sådan syntes. Hydracider används i huvudsak för att lösa upp olika typer av materia. Detta beror på att de är starka syror, och med mått kan de rengöra vilken yta som helst. Deras syraprotoner läggs till föreningarna av föroreningar eller smuts, vilket gör dem lösliga i den vattenhaltiga miljön och dras sedan av vattnet. Enligt den kemiska naturen hos nämnda yta kan en hydracy eller annan användas. Till exempel kan fluorhorhorinsyra inte användas för att rengöra glas eftersom det skulle lösa dem i handlingen. Saltsyran används för att ta bort fläckar på poolplattorna. De kan också lösa upp stenar eller fasta prover och används sedan för analytiska eller produktionsändamål till små eller stora skalor. I jonutbyteskromatografi används utspädd saltsyra för att rengöra den återstående jonkolonnen. Vissa reaktioner kräver mycket sura lösningar för att påskynda dem och minska tiden det äger rum. Det är här hydraciderna kommer in. Ett exempel på detta är användningen av IARHYDRIRA SYRE i syntesen av glacial ättiksyra. Oljeindustrin behöver också hydracery i raffinaderiprocesser. Hydracider ger inte bara syraprotoner, utan också deras respektive anjoner. Dessa anjoner kan reagera med en organisk eller oorganisk förening för att bilda en specifik halogenid. På detta sätt, fluorider, klorider, jodid. Dessa haluro kan ha mycket olika applikationer. Till exempel kan de användas för att syntetisera polymerer, såsom Teflon; eller mellanhänder, från vilka halogenatomer kommer att införlivas i molekylstrukturerna hos vissa läkemedel. Anta att molekylen ch3Ch2Åh, etanol, reagerar med HCl för att bilda etylklorid: Ch3Ch2OH + HCL => CH3Ch2Cl + H2ANTINGEN Var och en av dessa reaktioner döljer en mekanism och många aspekter som beaktas i organisk syntes. Det finns inte många exempel tillgängliga för hydracider, eftersom antalet möjliga föreningar är naturligt begränsat. Av denna anledning listas några ytterligare hydracider nedan med sin respektive nomenklatur (förkortningen (AC)) ignoreras: Binär hydraceid vars H-F-molekyler bildar starka vätebroar, så att det i vatten är en svag syra. Till skillnad från de hydracider som beaktas fram till dess är det polyiatomiskt, det vill säga den har mer än två atomer, men den fortsätter att vara binär eftersom de är två element: svavel och väte. Dess H-S-H-vinkelmolekyler bildar inte märkbara vätebroar och kan upptäckas med deras karakteristiska ruttna av ruttna ägg. En av de mest kända syrorna i populärkulturen. Det är till och med en del av sammansättningen av gastrisk juice, närvarande i magen, och tillsammans med matsmältningsenzymer de förnedrar mat. Som iarhydronsyra består den i en gasfas av H-BR-linjära molekyler, som dissocierar på hjonerna+ (H3ANTINGEN+) och br- När de kommer in i vattnet. Även om Telurio har en viss metallisk karaktär, avger dess hydcens obehagliga och extremt giftiga ångor, såsom seleenhydronsyra. Såväl som den andra hydracy2-, Så hans Valencia är -2.Hydraciders nomenklatur
Vatten-
I vattenlösning
Hur är Hydrace?
Direkt upplösning av vätehalider
Icke -metallsalter upplösning med syror
Hydraces användning
Städare och lösningsmedel
Syrakatalysatorer
Reagens för syntes av organiska och oorganiska föreningar
Exempel på hydracest
HF, fluorhorinsyra
H2S, sulfhydronsyra
HCl, saltsyra
HBR, bromhydronsyra
H2Te, telurhydronsyra
Referenser

