Intermolekylära krafter
- 816
- 171
- Karl Johansson
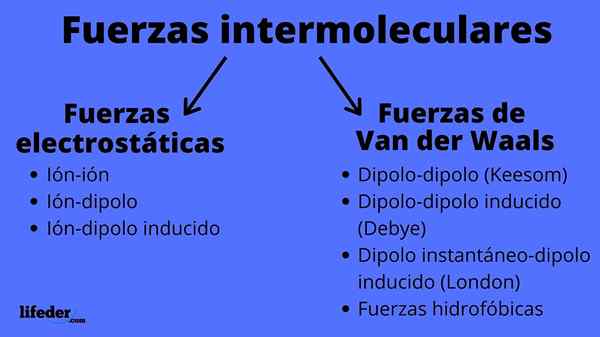
 Schema av intermolekylära krafttyper
Schema av intermolekylära krafttyper Vad är intermolekylära krafter?
De Intermolekylära krafter De är en uppsättning interaktioner som äger rum mellan molekylerna, vare sig det är samma kemiska förening eller inte, och som håller dem tillsammans. Tack vare dessa krafter lyckas molekylerna gruppera och definiera en fast, vätska eller gas; det vill säga de är ansvariga för de fysiska egenskaperna hos ämnen.
Intermolekylära krafter kan vara av två typer: elektrostatiska eller van der Waals. De elektrostatiska är alla de där vi har joner, som är elektriskt laddade atomer eller molekyler (+ eller -). Samtidigt involverar de från van der Waals neutrala atomer eller molekyler, som genom fluktuationer i deras elektroniska distribution är polariserade och lockade eller avvisade med varandra.
Intermolekylära krafter kan jämföras med den befintliga föreningen mellan olika bitar av lekmän. Beroende på deras formulär och riktlinjer blir deras fackföreningar svagare eller svagare, precis som de ändrar konstruktionens design och slutliga dimensioner.
Ju starkare dessa krafter är, desto svårare blir det att skilja bitarna av lekmän eller, i fallet med kemi, molekylerna. Detta innebär också att det kommer att bli större komprimering och att molekylerna därför kommer att definiera mer viskösa vätskor, tyngre eller tätare gaser.
Andra fysiska egenskaper såsom fusions- och kokpunkter, volatilitet, struktur, etc., De är också makroskopiska reflexer av de intermolekylära krafterna som styr mellan molekylerna eller jonerna av en förening eller blandningar. Till exempel: gasernas intermolekylära krafter är mycket svaga jämfört med en sten.
Att förstå intermolekylära krafter är avgörande för att beskriva många av de kemiska, fysiska och biologiska begreppen.
Elektrostatiska krafter
Jonjon
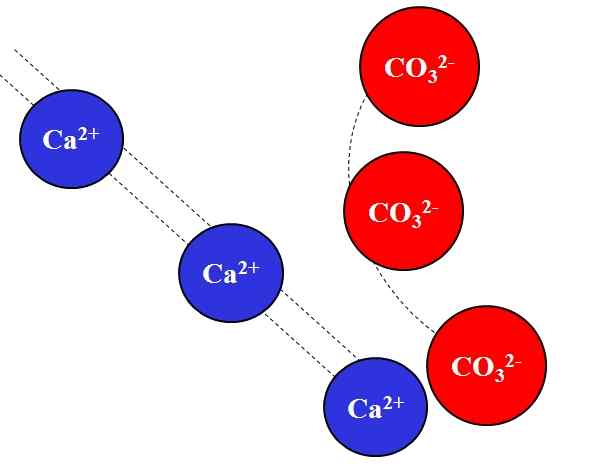 Elektrostatisk attraktion mellan Ca2+ och CO32 -joner-. Källa: Gabriel Bolívar.
Elektrostatisk attraktion mellan Ca2+ och CO32 -joner-. Källa: Gabriel Bolívar. Motsatta laddningar lockar joner med stor kraft, vilket beror på Coulombs lag, och minskar snabbt desto mer går jonerna bort.
Till exempel cajonen2+ Det är positiv laddning, en katjon, medan CO32- Det är en negativ belastning, en anjon. Att vara dina motsatta laster, CA2+ och co32- De lockar varandra och bevisar att ju närmare de är, desto mer tillsammans kommer de att förbli.
Tvärtom, joner med samma belastning, vare sig det är positiva eller negativa, avvisar med samma kraft men i motsatt mening. Således CA2+ Avvisande till joner som Na+, Mg2+, K+, etc., såvida det inte finns andra anjoner som minskar avstötningen.
Det kan tjäna dig: Dibenzalacetona: egenskaper, reaktionsmekanism, användningar, riskerAv alla intermolekylära krafter är de av jon-jon-typen den enklaste; Men samtidigt den starkaste av alla. Mycket energi eller värme behövs för att separera jonerna.
Jon-dipolo
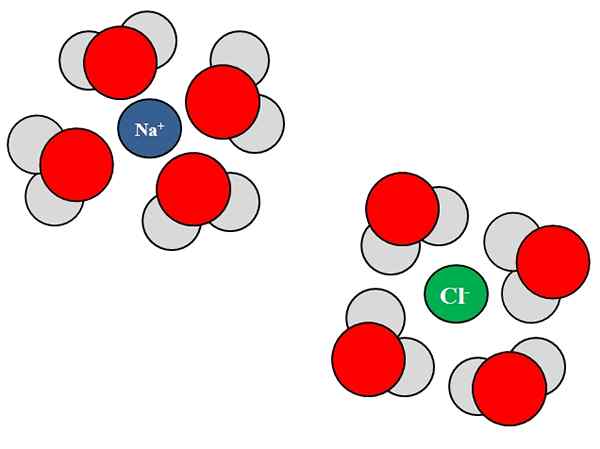 Jon-dipolo-interaktioner mellan vattenmolekyler och NaCl-joner. Källa: Gabriel Bolívar.
Jon-dipolo-interaktioner mellan vattenmolekyler och NaCl-joner. Källa: Gabriel Bolívar. Joner kan också interagera med neutrala atomer eller molekyler, såsom vatten. Detta gäller särskilt när det gäller molekylerna i ett lösningsmedel, som solvata, det vill säga omger jonerna i deras vätska.
Till exempel består natriumklorid, NaCl, av Na -joner+ och cl-. När deras kristaller kastas i vattnet, vattenmolekylerna, h2O eller HOH, hydrat eller omger jonerna av NaCl; Men hur de gör varierar beroende på jonen i fråga.
Således ser vi i den överlägsna bilden att jonen na+ är hydratiserad av H H syreatomer2ANTINGEN. Under tiden jon cl- är hydratiserad av väteatomer.
Därför att? Eftersom vatten är ett polärt ämne, vilket innebär att det har en dipol: en stolpe med en positiv partiell belastning och en annan med en negativ partiell belastning.
Syreatomen, eftersom den är mer elektronegativ, lockar elektronerna mot sig själva och lokaliserar därmed elektronerna oftare runt den atomen; något som inte händer samma sak med väteatomer, mindre elektronegativt. Syre, eftersom det är mer negativt, är orienterat mot NA+; Medan hydrogener, eftersom de är mer positiva, är inriktade på CL-, Eftersom motsatta avgifter lockas.
Inducerad jon-dipolo
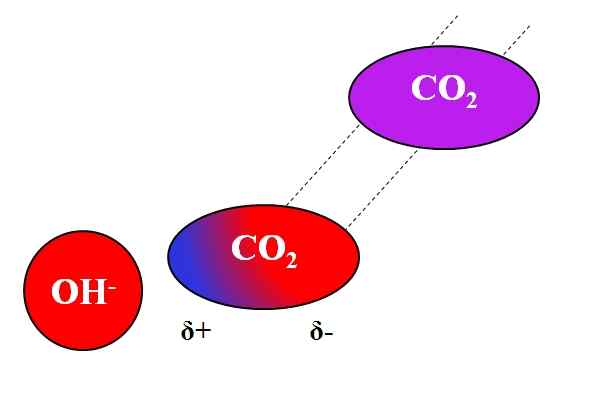 Induktiv åtgärd oh- på co₂-molekylen. Källa: Gabriel Bolívar.
Induktiv åtgärd oh- på co₂-molekylen. Källa: Gabriel Bolívar. Inte bara polar- eller dipolesmolekyler kan interagera med joner. För neutrala atomer eller molekyler, även om de inte har dipoler, är fördelningen av deras elektroner mottaglig för de induktiva effekterna av närliggande joner; Det vill säga jonerna orsakar en tillfällig och kort polarisering, tillräckligt för en anmärkningsvärd interaktion.
Kan tjäna dig: blyacetat: struktur, egenskaper, erhållning, användningAnta till exempel interaktionen mellan OH -jon- och CO2. Kompaniet2 Det är en neutral förening, vars molekyl (i lila) saknar dipol. Men som åh närmar sig-, Den negativa belastningen av detta avvisar elektronerna i syreatomerna i CO2.
Ju närmare OH är- och CO2, Starkare kommer att vara avvisande. Följaktligen börjar en dipol inducerad av OH fastställas- Om Co2. En positiv pol visas 5+ eftersom elektroner, avvisade, "emigrerar" till den andra änden av molekylen.
Således, åh- och CO2 De förblir tillräckligt tillsammans för att reagera med varandra. Detta är anledningen till att co2 Det är särskilt lösligt i alkaliska lösningar.
Van der Waals styrkor
Van der Waals styrkor hänvisar i princip endast till de som finns mellan neutrala atomer eller molekyler, utan joniska belastningar.
Dipolo-dipolo (Keesom)
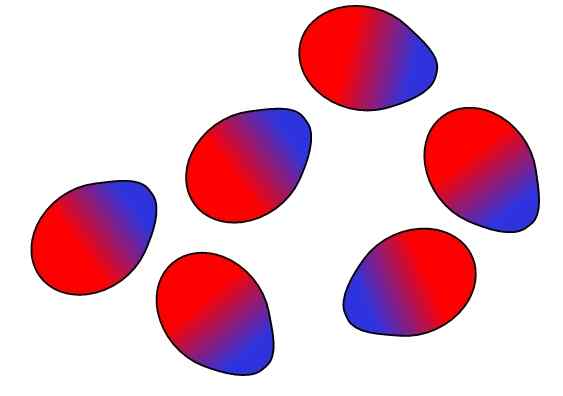 Dipolo-dipolo-styrkor. Källa: Gabriel Bolívar.
Dipolo-dipolo-styrkor. Källa: Gabriel Bolívar. Motsatta avgifter lockas, lika stora belastningar avvisar. Detsamma gäller för dipolerna: motsatta poler (5+ och Δ-) lockas, medan lika poler avvisar. De positiva polerna eller 5+ representeras ovan med den blå färgen, men att de negativa polerna eller 5- är representerade med den röda färgen.
Observera hur de övre molekylerna är orienterade och beställda på ett sådant sätt att de motsatta polerna är, flyttar bort i processen till lika polerna. Denna beställning är det som kallas interaktioner eller krafter Dipolo-dipolo (Keesom Forces) och är de viktigaste intermolekylära krafterna mellan polära molekyler.
Till exempel H -molekyler2Eller, HCl, HF, CO, bland andra, de beställs i liknande lägen. Ju mer polära de är, desto starkare kommer dess dipol-dipolo-krafter att vara; Och därför är det svårare att skilja sina molekyler.
HF är mer polär än HCL, så kokpunkten för HF är överlägsen (19.5 ºC) till HCl (-85.05 ºC). Det är otroligt effekten som intermolekylära krafter har på fysiska egenskaper. Den minsta variationen och ämnet kommer att bete sig helt annorlunda än vad som förväntades.
Kan tjäna dig: Gaseous State: Egenskaper, allmän lag, exempelInducerad dipolo-dipolo (Debye)
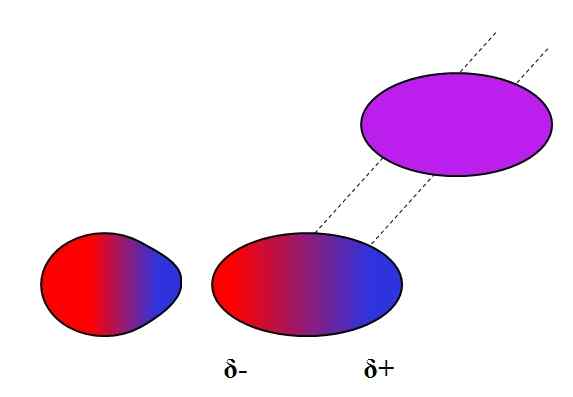 Inducerad dipolo-dipolo. Källa: Gabriel Bolívar.
Inducerad dipolo-dipolo. Källa: Gabriel Bolívar. Dipolos, som joner, kan också variera eller påverka den elektroniska fördelningen av neutrala atomer eller molekyler. Således ser vi, i den överlägsna bilden, att en dipol plötsligt polariserar en neutral molekyl. Det sägs därför att det är en inducerad dipol-dipolkraft, eftersom den andra dipolen är tillfällig, inte permanent.
Till exempel kan vatten lösa upp en liten mängd eller2, Men tillräckligt för att marin fauna kan andas. Om h2Eller kunde inte inducera en dipol i O2, Allt syre i havet skulle undkomma ytan, eftersom det inte skulle finnas några interaktioner mellan båda molekylerna.
Omedelbar dipolo-inducerad Dipolo (London)
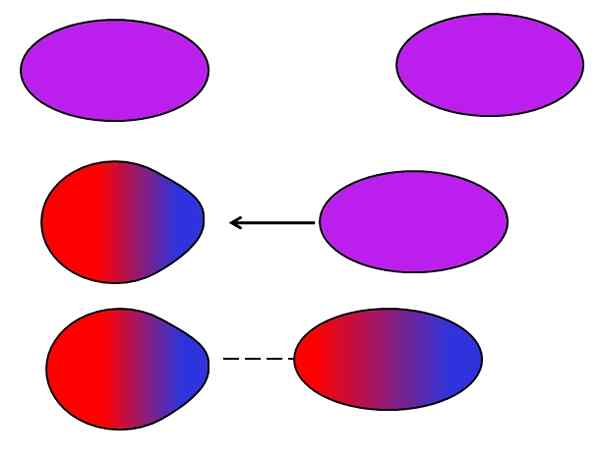 Londonstyrkor. Källa: Gabriel Bolívar.
Londonstyrkor. Källa: Gabriel Bolívar. Neutrala atomer eller molekyler behöver inte angränsande joner eller dipoler för att lida för sig själva fluktuationer i fördelningen av deras interna belastningar. Elektronerna är inte stilla, men rör sig genom molekylen. Vid någon tidpunkt kommer en omedelbar dipol att äga rum, som om den är mycket nära en neutral molekyl eller atom, kommer att inducera en dipol i dem (se ovan).
Ju större och asymmetriska dessa molekyler, desto mer troligt kommer de omedelbara dipolerna att inträffa. Det är därför föreningarna med de högsta atommassorna har en inducerad omedelbar dipolkraft-inducerad mer intensiv. Denna typ av van der Waals -styrkor är bättre känd som London Forces.
Till exempel ädla gaser (han, NE, AR, etc.) De förblir förenade tack vare London -styrkorna, precis som luftgaser (eller2, N2, Co2, etc.). Dessutom är denna kraft den mest dominerande bland kolväten som metan, Cho4, Och propan, cho3Ch2Ch3.
Hydrofoba krafter
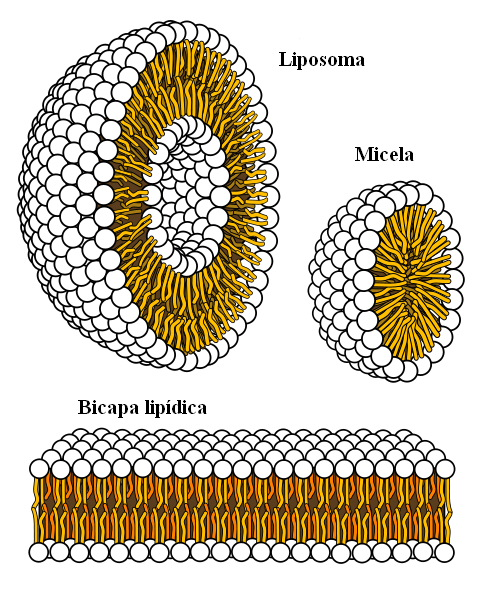 Supramolekylära strukturer härstammar från hydrofoba krafter
Supramolekylära strukturer härstammar från hydrofoba krafter Slutligen har vi hydrofoba krafter, som är ett speciellt resultat av London -krafter och avvisningar mellan ämnen med olika polariteter. Fetter är lite relaterade till vatten, så det är olösligt i detta.
Fettmolekyler försöker gruppera på ett sådant sätt att deras interaktion med vatten är så mycket som möjligt, och detta lyckas bilda 3D -strukturer som de som visas ovan.
Således samlas fettmolekyler, såsom fosfolipider, för att bilda lipid -tvåskikt, miceller och liposomer.
Om de observeras har dessa molekyler ett vitt huvud som representerar en polär del, relaterad till vatten; liksom en apolär svans, som avvisar vattenmolekylerna. Linjerna försöker placera sig i dessa supramolekylära strukturer, så att de inte interagerar med vatten.

