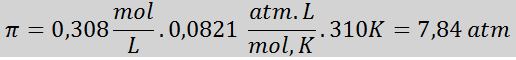Koligativa egenskaper hos lösningar
- 2957
- 895
- Hans Olsson
Vad är Coligative Egenskaper?
De Kolligativa egenskaper, Även kallade kollektiva egenskaper hos lösningar, de är en grupp på fyra egenskaper som enbart beror på mängden partiklar som finns i lösningen, men inte på dessa partiklar.
Med andra ord, dessa egenskaper uppstår från närvaron av andra partiklar än lösningsmedlet, det vill säga partiklar av det lösta ämnet, men beror inte på vem som är lösta ämnet. Alla typer av partiklar kan ge upphov till coligativa egenskaper, oavsett om det är atomer, joner eller molekyler. Det enda som är viktigt är din koncentration.
De karigativa egenskaperna är fyra:
- Beslut om ångtrycket från lösningsmedlet
- Ebullloskopisk höjd
- Krioscopisk härkomst
- Osmotisk tryck
Alla kännetecknas av att vara proportionella mot koncentrationen av det lösta ämnet vid relativt utspädda lösningar (koncentration <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Låt oss se var och en av dessa fyra egenskaper i detalj:
1. Beslut om ångtrycket från lösningsmedlet
När en icke -volatil lösta lösning framställs är ångtrycket för den resulterande lösningen alltid mindre än ångtrycket för det rena lösningsmedlet. Med andra ord, lösa upp ett icke -volatilt lösta ämnen i ett lösningsmedel, orsakar en minskning av ångtrycket från nämnda lösningsmedel, jämfört med det rena lösningsmedlet.
Formel för ångtryck minskar
Liksom alla koligativa egenskaper är minskningen av ångtryck (DP) proportionell mot koncentrationen av lösta ämnet. Genom att kombinera Raaults lag med de molära fraktionsekvationerna kan det demonstreras att DP ges av:
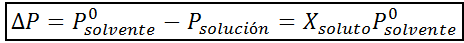
där p °lösningsmedel representerar ångtrycket för det rena lösningsmedlet vid en viss temperatur, slösning motsvarar lösningens ångtryck och xlösta representerar koncentrationen av det lösta ämnet som uttrycks som molfraktion.
Varför minskar ångtrycket med det lösta ämnet?
Kraften som driver de flesta naturliga processer, såsom indunstning av ett lösningsmedel, är ökningen av entropi eller störningsnivå. När en vätska förångas går den från ett mycket ordnat tillstånd (i vätskan) till en mycket rörig (i gas), eftersom det i gasfasen finns mycket mer rörelsefrihet.
Kan tjäna dig: Violet GlassI en lösning lägger emellertid närvaron av lösta ämnen i vätskefasen medan den inte påverkar gasfasen (eftersom lösta ämnet inte förångas).
Av denna anledning är skillnaden i nivån på störning mellan lösningen och gasfasen mindre än mellan det rena lösningsmedlet och gasfasen, så lösningsmedlet har mindre tendens att avdunsta i det andra fallet.
Exempel
Problem: Genom att veta att vattenångtrycket vid en viss temperatur är 30,55 mmHg, bestäm ångtrycket för en beredd lösning som löser 7,20 gram glukos (molmassa eller mm = 180 g/mol) i 360 g vatten (mm = 18,0 g/mol) vid samma temperatur.
Lösning: I detta fall måste den molära fraktionen av lösta ämnet beräknas först. Vi har redan all nödvändig information för detta:
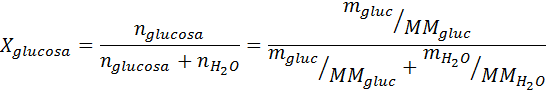
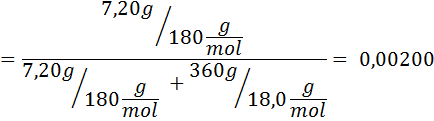
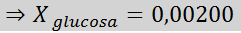
Då appliceras ekvationen av ångtrycksminskning.
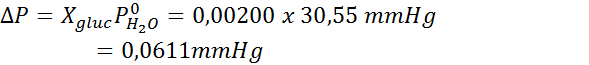
Nu bestämmer vi lösningsmedlets nya ångtryck:
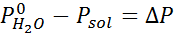
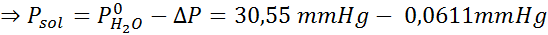
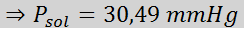
2. Ebullloskopisk höjd eller kokpunkt
Ebullloskopisk höjd avser ökningen av kokpunkten för en lösning jämfört med kokpunkten för rent lösningsmedel. För att förstå varför detta händer, kom ihåg att kokpunkten definieras som temperaturen vid vilken ångtrycket på en vätska görs lika med atmosfärstrycket.
Eftersom lösningarna har ett mindre ångtryck än det rena lösningsmedlet (som vi just har sett i föregående avsnitt) är det nödvändigt att värma det mer för att kunna nå atmosfärstrycket och därmed nå sin kokpunkt. Av denna anledning är kokpunkten för lösningarna (med icke -flyktiga lösta ämnen) alltid större än det för det rena lösningsmedlet.
Ebullloskopisk höjdformel
Ökningen av kokpunkten (DTb) Det är proportionellt mot koncentrationen av det lösta ämnet som uttrycks i malalitet, vilket indikeras av följande ekvation:
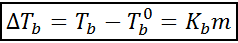
Där tb Det är kokpunkten för lösningen, tb° Det är kokpunkten för rent lösningsmedel, kb Det är den ebullloskopiska konstanten hos lösningsmedlet och m Det är löstens malalitet.
Exempel
Problem: Att veta att den kokande vattenkonstanten är 0,52 ° C.kg/mol, bestäm kokpunkten för glukoslösningen framställd i föregående exempel.
Lösning: För att bestämma den ebullloskopiska höjd behöver vi bara moral.
Kan tjäna dig: tennoxid (ii): struktur, egenskaper, nomenklatur, användning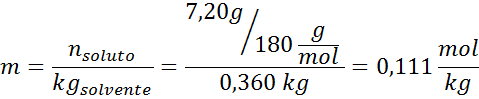
Nu tillämpar vi DT -formelnb:
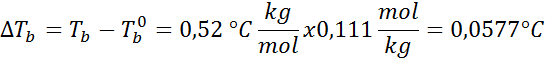
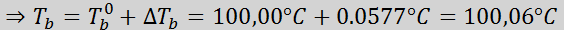
3. Krioscopisk härkomst
Den kryoskopiska minskningen är minskningen av fryspunkten för en lösning jämfört med fryspunkten för det rena lösningsmedlet. Anledningen till att detta händer liknar den ebullloskopiska ökningen och har sitt ursprung i minskningen av ångtrycket.
Den här egenskapen används allmänt i kallt väder där den snöar på vintern. I dessa länder är det mycket vanligt att se lastbilar sprida salter som NaCl eller CaCl2 på vägar eller på offentliga bänkar, varefter snö smälter. Anledningen till att det smälter är att salt minskar vattenfrysningspunkten.
Crioscopic härkomstformel
Den krioskopiska nedstigningsekvationen är mycket lik den för den ebullloskopiska ökningen. Det är också proportionellt mot den moraliska koncentrationen och beror i detta fall på en kryoskopisk konstant av lösningsmedlet.
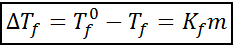
där tF Det är lösningspunkten för lösningen, tF° Det är fryspunkten för rent lösningsmedel, kF Det är den krioskopiska konstanten hos lösningsmedlet och m Det är löstens malalitet.
Exempel
Problem: Att veta att den kryoskopiska vattenkonstanten är 1,86 ° C.kg/mol, bestäm fryspunkten för glukoslösningen framställd i föregående exempel.
Lösning: Lösningens moral bestämdes redan, så vi kan direkt bestämma DTF Använda den tidigare formeln:
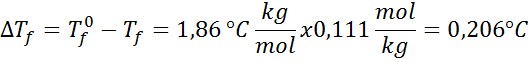
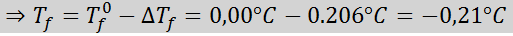
4. Osmotisk tryck
Osmos är en process av stor betydelse på kemisk och biologisk nivå. Detta består av flödet av lösningsmedelsmolekyler (till exempel vatten) från en utspädd lösning till en annan mer koncentrerad lösning när de separeras med hjälp av ett semipermeabelt membran (som bara låter lösningsmedlet endast passera, men inte den lösta ämnet).
Denna tendens att "absorbera" lösningsmedel genom ett semipermeabelt membran är en egenskap som enbart beror på den totala koncentrationen av lösta partiklar som finns i lösningen, oavsett vilken lösta ämnet det är. Av denna anledning är denna trend en koligativ egenskap och mäts genom osmotiskt tryck.
Osmotiskt tryck (π) är trycket som bör appliceras på en lösning för att stoppa osmosen. Ju större det osmotiska trycket, desto mer tendens att lösningen ska absorbera lösningsmedel (eller mer exakt, desto mer trend har lösningsmedlet att spridas mot den lösningen) lösningen).
Kan tjäna dig: magnesium: historia, struktur, egenskaper, reaktioner, användningarVarför inträffar osmos?
Förklaringen bakom osmosprocessen är mycket enkel. Alla ämnen tenderar att spridas där de är mer koncentrerade där de är mer utspädda. Detta berättas att följa din koncentrationsgradient.
När en lösning är mer koncentrerad i lösta. Av denna anledning har lösningsmedlet en naturlig tendens att gå från den mest utspädda lösningen (där lösningsmedlet är mer koncentrerat) mot den mest koncentrerade lösningen (där det är mer utspädd).
Osmotisk tryckformel
Osmotiskt tryck kan beräknas med en formel som är mycket lik ekvationen för idealiska gaser:
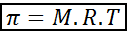
I denna ekvation är π det osmotiska trycket, M är den molära koncentrationen av det lösta ämnet, r är den universella konstanten av idealiska gaser (0,0821 atm.L/mol.K) och t är den absoluta temperaturen i k.
Osmotiskt tryck och tonicitet
Osmotiskt tryck är mycket viktigt för att människokroppen fungerar. Faktum är att saltlösningarna som injiceras intravenöst klassificeras beroende på om deras osmotiska tryck är större, lika med eller mindre än blodplasma som det kallas tonicitet.
- En mindre koncentrerad lösning att plasma har ett lägre osmotiskt tryck och berättas Hypotonlösning.
- Om du har samma totala koncentration av lösta ämnen berättas det isotonisk lösning.
- Om du har ett större osmotiskt tryck (eller koncentration), berättas det hypertonisk lösning.
Exempel
Problem: Beräkna det osmotiska trycket vid 310 K av en 0,9% saltlösning (M/V), som är isotonisk med blodplasma.
Lösning: Vi har redan temperaturen, så det enda som saknas är att bestämma den molära koncentrationen av saltpartiklarna (NaCl) i lösningen. För detta.
Varje 100 ml lösning innehåller 0,9 g NaCl, så:
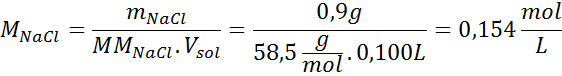
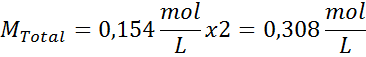
Detta är den totala koncentrationen av lösta partiklar i lösningen, så nu kan vi beräkna det osmotiska trycket: