Molekylär geometri -koncept, typer och exempel
- 1027
- 127
- Hans Olsson
De Molekylgeometri antingen molekylär struktur Det är den rumsliga fördelningen av atomer runt en central atom. Atomer representerar regioner där det finns en hög elektronisk densitet och betraktas därför som elektroniska grupper, oavsett länkar som bildas (enkla, dubbla eller tredubbla).
Molekylgeometri för ett element kan karakterisera några av dess fysiska eller kemiska egenskaper (kokpunkt, viskositet, densitet, etc.). Till exempel bestämmer vattenstrukturen för vatten dess löslighet.
 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Detta koncept är född från kombinationen och experimentella data från två teorier: den för Valencia -länken (TEV) och avvisningen av de elektroniska paren i Valencia -lagret (RPECV). Medan den första definierar länkarna och deras vinklar, upprättar den andra geometri och följaktligen molekylstrukturen.
Vilka geometriska former kan anta molekyler? De två tidigare teorierna bidrar med svaren. Enligt RPECV måste atomerna och paren av fria elektroner ordnas i rymden på ett sådant sätt att den elektrostatiska avstötningen mellan dem minskar till det maximala.
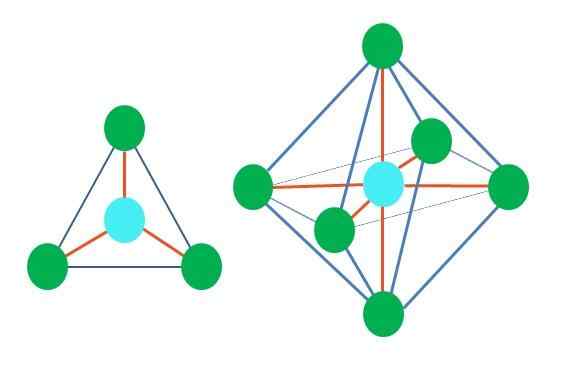
Så geometriska former är inte godtyckliga, men söker den mest stabila designen. Till exempel kan en triangel i den övre bilden ses till vänster, och till höger en oktaedron. Gröna punkter representerar atomerna och orange ränderna länkarna.
I triangeln är de tre gröna punkterna orienterade i en separering av 120º. Denna vinkel, som är lika med länken, gör att atomer kan avvisa varandra som möjligt. Därför kommer en molekyl med en central atom fäst vid tre andra att anta en platt trigonal geometri.
RPECV förutspår emellertid att ett par fria elektroner i den centrala atomen kommer att förvränga geometrien. När det gäller det trigonala planet kommer detta vridmoment att trycka ner de tre gröna punkterna, vilket resulterar i en trigonal pyramidgeometri.
Detsamma kan också hända med bildens oktaedron. I det är alla atomer åtskilda på det mest stabila sättet som möjligt.
[TOC]
Hur man vet i förväg molekylgeometri för en atom x?
För detta är det också nödvändigt att betrakta gratis elektroner som elektroniska grupper. Dessa, tillsammans med atomerna, kommer att definiera vad som kallas Elektronisk geometri, som är en oskiljbar följeslagare av molekylgeometri.
Från elektronisk geometri och efter att ha upptäckt paren av fria elektroner genom Lewis -strukturen kan det fastställas vilken molekylär geometri kommer att vara. Summan av alla molekylgeometrier ger en skiss av den globala strukturen.
Typer av molekylgeometri
Som framgår av huvudbilden beror molekylgeometri på hur många atomer som omger den centrala atomen. Men om ett par elektroner är närvarande utan att dela kommer det att modifiera geometri eftersom den upptar mycket volym. Därför utövar det en sterisk effekt.
Enligt detta kan geometri presentera en serie karakteristiska former för många molekyler. Och det är här de olika typerna av molekylgeometri eller molekylstruktur uppstår.
När är geometri lika med strukturen? Båda anger detsamma endast i fall där strukturen inte har mer än en typ av geometri; Annars måste alla närvarande typer övervägas och ge strukturen ett globalt namn (linjär, grenad, globulär, platt, etc.).
Kan tjäna dig: hydraceGeometrier är särskilt användbara för att förklara strukturen för ett fast ämne från dess strukturella enheter.
Linjär
Alla kovalenta bindningar är riktade, så A-B-länken är linjär. Men kommer molekylen AB vara linjär2? Om så är fallet är geometri helt enkelt representerad som: b-b. De två B -atomerna separeras med en vinkel på 180 °, och enligt TEV måste A Hybrid SP -orbitaler.
Vinkel
 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar En linjär geometri för AB -molekylen kan antas i första hand2; Det är emellertid viktigt att dra Lewis struktur innan man når en slutsats. Ritad Lewis -strukturen kan du identifiera antalet ovanliga elektronpar (:) På atomen.
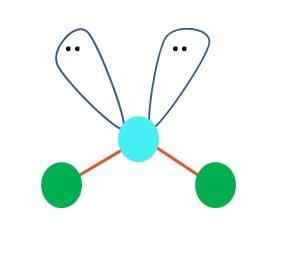
När detta är så, på paren av elektroner. Som ett resultat hamnar den B-A-B-linjära molekylen med att bli en V, en boomerang eller en vinkelgeometri (överlägsen bild)
Vattenmolekylen, H-O-H, är det perfekta exemplet för denna typ av geometri. I syreatomen finns det två par elektroner utan att dela som är orienterade i en ungefärlig vinkel på 109º.
Varför denna vinkel? Eftersom elektronisk geometri är tetraedral, som har fyra vertikaler: två för H -atomer och två för elektroner. I den överlägsna bilden, märk att de gröna punkterna och de två "Lobes with Eyes" drar en tetrahedron med blåaktig punkt i centrum.
Om OR inte hade fria elektroner, skulle vattnet bilda en linjär molekyl, dess polaritet skulle minska och haven, haven, sjöarna, etc., De skulle förmodligen inte existera som de känner varandra.
Tetraedral
 Källa: Gabriel Bolívar
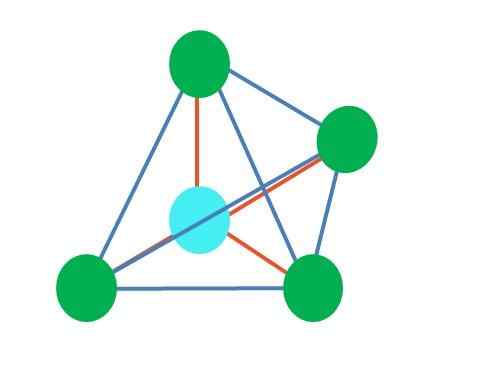
Källa: Gabriel Bolívar Den övre bilden representerar tetraedral geometri. För vattenmolekylen är dess elektroniska geometri tetraedral, men genom att eliminera elektronfria par kan det noteras att den förvandlas till en vinkelgeometri. Detta observeras också helt enkelt genom att eliminera två gröna punkter; De återstående två kommer att dra V med den blå punkten.
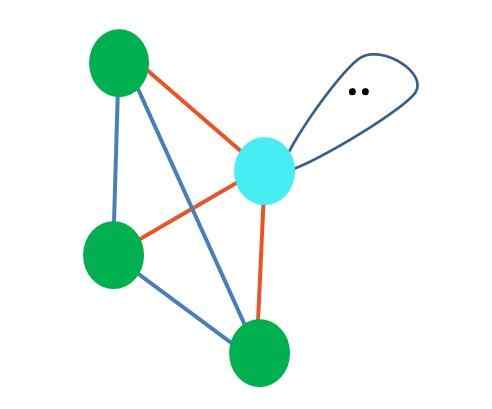
Vad händer om istället för två par gratis elektroner fanns det bara en? Då skulle det finnas ett trigonalt plan (huvudbild). Men genom att eliminera en elektronisk grupp undviks inte den steriska effekten som produceras av fria elektronerna. Därför snedvrider det det trigonala planet till en triangulär baspyramid:
 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Även om molekylär geometri trigonal och tetraedral pyramid är olika, är elektronisk geometri densamma: tetraedral. Så den trigonala pyramiden räknas inte som elektronisk geometri?
Svaret är nej, eftersom det är produkten från distorsionen orsakad av "loben med ögon" och dess steriska effekt, och sa att geometri inte tar hänsyn till senare snedvridningar.
Av denna anledning är det alltid viktigt att bestämma den första elektroniska geometri med hjälp av Lewis -strukturer innan man definierar molekylgeometri. Ammoniakmolekylen, NH3, Det är ett exempel på molekylär geometri trigonal pyramid, men med tetraedral elektronisk geometri.
Trigonal bipiramid
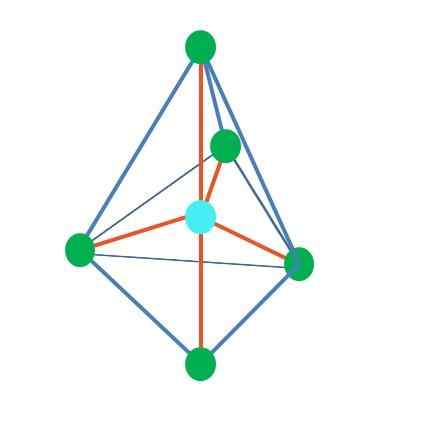 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Fram till nu, med undantag av linjär geometri, i tetraedrala, vinkel- och trigonala pyramid har deras centrala atomer SP -hybridisering SP3, Enligt Tev. Detta innebär att om dess länkvinklar experimentellt bestämdes, bör de vara cirka 109º.
Det kan tjäna dig: Tillämpad kemi: Subjekt för studier, grenar, betydelse, exempelFrån den trigonala difarmidala geometrien finns det fem elektroniska grupper runt den centrala atomen. I den övre bilden kan du se med de fem gröna punkterna; tre i den triangulära basen och två i axiella positioner, som är pyramidens övre och nedre toppar.
Vilken hybridisering har då den blå punkten? Den behöver fem hybrid orbitaler för att bilda enkla (orange) bindningar. Detta uppnår det genom de fem orbitalerna SP3D (produkt av blandningen av en orbital S, tre P och en D).
När man överväger fem elektroniska grupper är geometri redan exponerat, men med elektronpar utan att dela, lider det igen snedvridningar som genererar andra geometrier. På samma sätt uppstår följande fråga: Dessa par kan ockupera alla positioner för pyramiden? Dessa är: Axial eller ekvatorialen.
Axiella och ekvatoriala positioner
De gröna punkterna som utgör den triangulära basen är i ekvatoriala positioner, medan de två i de övre och nedre ändarna, i axiella positioner. Där företrädesvis elektronparet kommer att vara beläget utan att dela? I den positionen som minskar till den maximala elektrostatiska avstötningen och steriska effekten.
I axiellt läge skulle paret av elektroner göra "tryck" vinkelrätt (90º) på triangulär basis, medan om det var i ekvatorialläge skulle de återstående elektroniska grupperna av basen separeras 120º och trycka på de två ändarna vid 90º (istället för tre, som med basen).
Därför kommer den centrala atomen att försöka vägleda sina elektronfria kamrater i ekvatoriala positioner för att generera mer stabila molekylgeometrier.
Oscillerande och form av t
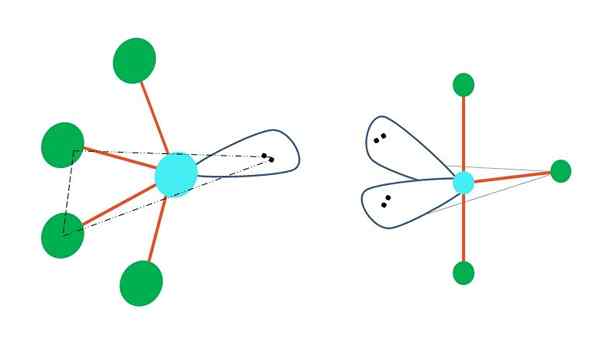 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Om en eller flera av dess atomer fria från elektroner byts ut i trigonal bipirramidgeometri, skulle olika molekylgeometrier också ha.
Till vänster om den övre bilden ändras geometri till den oscillerande formen. I den skjuter elektronfritt vridmoment resten av de fyra atomerna mot samma riktning och böjer sina länkar till vänster. Observera att detta vridmoment och två av atomerna ligger i samma triangulära plan för den ursprungliga bipiramiden.
Och till höger om bilden, geometrien i form av t. Denna molekylära geometri är resultatet av att ersätta två atomer med två par elektroner, vilket resulterar i att de återstående tre atomerna anpassar sig i samma plan som drar exakt en bokstav T.
Så för en molekyl av typ AB5, Detta antar trigonal bipyramidgeometri. Men AB4, Med samma elektroniska geometri kommer den att anta oscillerande geometri; och ab3, T -formad geometri. I alla kommer (i allmänhet) SP -hybridisering3d.
För att bestämma molekylgeometri är det nödvändigt att rita Lewis -strukturen och därför dess elektroniska geometri. Om detta är trigonal bipiramid kommer elektronfria par att kasseras, men inte deras steriska effekter på resten av atomerna. Således kan det helt urskiljas mellan de tre möjliga molekylära geometrierna.
Oktaedral
Till höger om huvudbilden representeras oktaedral molekylgeometri. Denna typ av geometri motsvarar AB -föreningar6. Ab4 De bildar den fyrkantiga basen, medan de återstående två B -positionerna själva i axiella positioner. Således bildas flera liksidiga trianglar, som är ansikten på oktaedronen.
Kan tjäna dig: aktiveringsenergiHär kan det återigen finnas (som i alla elektroniska geometrier) fria elektronpar, och därför härstammar från detta faktum andra molekylgeometrier. Till exempel AB5 Med octronistisk elektronisk geometri består den av en pyramid med fyrkantig bas och AB4 av ett fyrkantigt plan:
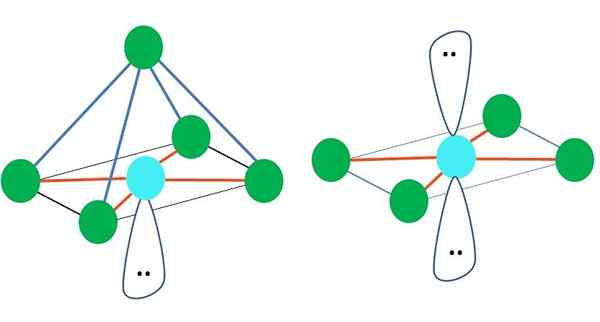 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar När det gäller oktronistisk elektronisk geometri är dessa två molekylära geometrier de mest stabila när det gäller elektrostatisk avstötning. I den fyrkantiga platta geometrien separeras de två elektronerna 180º.
Vad är hybridisering för atom i dessa geometrier (eller strukturer, om det är den enda)? Återigen konstaterar TEV att det är SP3d2, Sex hybrid orbitaler, som gör att du kan vägleda elektroniska grupper i vertikalerna i en oktaedron.
Andra molekylära geometrier
Modifiera baserna i de nämnda pyramiderna hittills kan några mer komplexa molekylgeometrier erhållas. Till exempel är den femkantiga bipiramiden baserad på en Pentagon och föreningarna som form har allmän formel AB7.
Liksom de andra molekylgeometrierna kommer att ersätta B -atomer med elektronfria par att förvränga geometri till andra former.
Också föreningar AB8 De kan anta geometrier som fyrkantig antiprism. Vissa geometrier kan bli mycket komplicerade, särskilt för AB -formler7 Från och med nu12).
Exempel på molekylär geometri
En serie föreningar kommer att nämnas nedan för var och en av de viktigaste molekylära geometrierna. Som en övning kan Lewis -strukturer dras för alla exempel och certifiera om molekylgeometrier, med tanke på elektronisk geometri.
Linjär geometri
-Eten, h2Conom2
-Berylliumklorid, becl2 (Cl-cl)
-Koldioxid, co2 (O = c = o)
-Kväve, n2 (N≡N)
-Mercury Dibromure, HGBR2 (Br-hg-br)
-Triyoduro -anjon, i3- (I-i-i)
-Madehydric Acid, HCN (H-N≡C)
Dess vinklar måste vara 180 ° och därför ha SP -hybridisering.
Vinkelgeometri
-Vatten
-Svaveldioxid, så2
-Kvävedioxid, nej2
-Ozon, eller3
-Amiduro -anjon, NH2-
Trigonal lägenhet
-Brom trifluorid, bf3
-Aluminium triklorid, alcl3
-Nitratanjon, nej3-
-Karbonatanjon, co32-
Tetraedral
-Gasmetano, ch4
-Koltetraklorid, CCL4
-Ammoniumkatjon, NH4+
-Sulfatanjon, så42-
Trigonal pyramid
-Ammoniak, NH3
-Hydronio katjon, h3ANTINGEN+
Trigonal bipiramid
-Fosfor pentafluoruro, pf5
-Antimon pentaklorid, SBF5
Oscillerande
Svavel tetrafluorid, SF4
Form av t
-Jod triklorid, ICL3
-Klor trifluorid, clf3 (Båda föreningarna är kända som mellanhalogener)
Oktaedral
-Hexafluoruro av svavel, SF6
-Selen Hexafluoruro, sef6
-Hexaflorophosfat, pf6-
För att kulminera är molekylär geometri den som förklarar observationerna av de kemiska eller fysiska egenskaperna hos saken. Emellertid är den orienterad enligt elektronisk geometri, så att den senare alltid måste bestämmas före den första.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan.). Cengage Learning, s 194-198.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan., p. 23, 24, 80, 169). MC Graw Hill.
- Märke. Tuckerman. (2011). Molekylär geometri och VSEPR -teorin. Återhämtat sig från: NYU.Edu
- Virtuell kembok, Charles och. Owdardt. (2003). Introduktion till molekylär geometri. Återhämtat sig från: kemi.elmhurst.Edu
- Kemi librettexts. (8 september 2016). Geometri av molekyler. Återhämtad från: kem.Librettexts.org
- « Pedagogiska undervisningsmodeller (traditionell och nuvarande)
- De 25 mest populära traditionella spelen »

