Karbonylgruppens egenskaper, egenskaper, nomenklatur, reaktivitet
- 1707
- 451
- PhD. Lennart Johansson
han Karbonylgrupp Det är en organisk och syresatt funktionell grupp som liknar kolmonoxidgasmolekylen. Det representeras som C = O, och även om det anses vara organiskt, kan det också hittas i oorganiska föreningar; Som kolsyra, h2Co3, eller i organometalliska föreningar med CO som bindning.
Det är emellertid i kolkemi, liv, biokemi och andra analoga vetenskapliga grenar där denna grupp sticker ut för sin enorma betydelse. Om det inte vore för honom, kunde många molekyler inte interagera med vatten; Proteiner, sockerarter, aminosyror, fetter, nukleinsyror och andra biomolekyler skulle inte existera om det inte var för det.
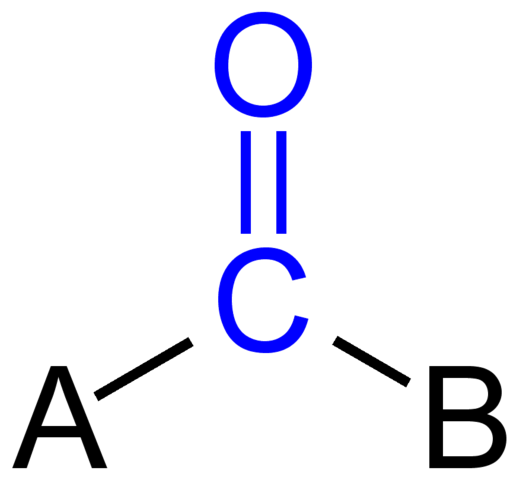
 Karbonylgrupp. Källa: Jü [Public Domain]
Karbonylgrupp. Källa: Jü [Public Domain] Den övre bilden visar hur denna grupp ser ut i det allmänna skelettet i en förening. Observera att det markeras av färgen blå, och om vi tog bort ersättningarna A och B (R eller R ', lika giltiga), skulle det finnas en molekyl av kolmonoxid. Närvaron av dessa substituenter definierar ett stort antal organiska molekyler.
Om A och B är kolatomer, såsom metaller eller icke -metalliska element, kan organometalliska eller oorganiska föreningar göras. När det gäller organisk kemi kommer substituenter A och B alltid att vara väteatomer, kolsyrade linjer, med eller utan förgreningar, cykliska eller aromatiska ringar.
Således börjar det förstå varför karbonylgruppen är ganska vanligt för dem som studerar naturliga eller hälsovetenskaper; Det är överallt, och utan det skulle de molekylära mekanismer som inträffar i våra celler inte inträffa.
Om dess relevans skulle kunna sammanfattas, skulle det sägas att det ger polaritet, surhet och reaktivitet på en molekyl. Där det finns en karbonylgrupp är det mer än troligt att molekylen bara vid den punkten kan drabbas. Därför är det en strategisk plats att utveckla organisk syntes genom oxidationer eller nukleofila attacker.
[TOC]
Karbonylgruppens egenskaper och egenskaper
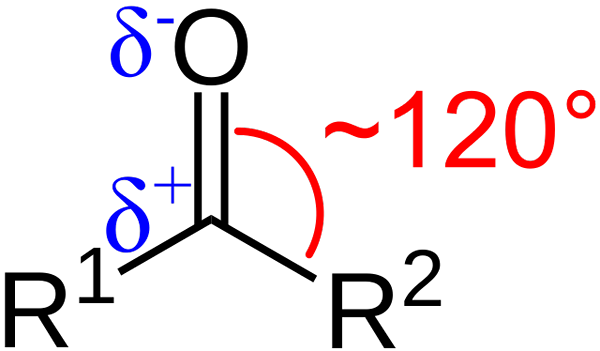 Karbonylgruppens strukturella egenskaper. Källa: Azaline Gomberg [Public Domain].
Karbonylgruppens strukturella egenskaper. Källa: Azaline Gomberg [Public Domain]. Vilka är de strukturella och elektroniska egenskaperna hos karbonylgruppen? Upp1 och r2 istället för A och B, som finns mellan substituenterna och syreatomen en vinkel på 120 ° C; Det vill säga geometri runt denna grupp är trigonal platt.
Vad är geometrien sådan2; Således kommer kol att ha tre SP -orbitaler2 För att bilda enkla kovalenta länkar med R1 och r2, och en orbital p Ren att etablera dubbelbindning med syre.
På detta sätt förklaras det hur det kan finnas en dubbelbindning C = O.
Om bilden observeras kommer det också att ses att syre har större elektronisk densitet, Δ-, än kol, 5+. Detta beror på att syre är mer elektronegativt än kol och därför "stjäl" elektronisk densitet; Och inte bara för honom, utan också till substituenterna r1 och r2.
Följaktligen genereras ett permanent dipolmoment, vilket kan vara av större eller mindre storlek beroende på molekylstrukturen. Där det finns en karbonylgrupp kommer det att finnas dipolmoment.
Resonansstrukturer
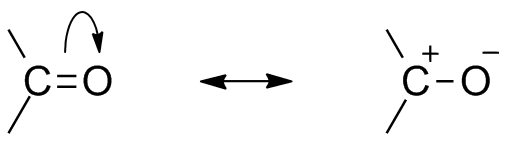 De två resonansstrukturerna för denna organiska grupp. Källa: Mfomich [CC0]
De två resonansstrukturerna för denna organiska grupp. Källa: Mfomich [CC0] En annan konsekvens av syreelektroniviteten är att i karbonylgruppen finns resonansstrukturer som definierar en hybrid (kombinationen av de två strukturerna i den överlägsna bilden). Observera att elektronparet kan migrera till omloppet p av syre, som lämnar kolatomen med en positiv partiell belastning; En Carbocation.
Kan tjäna dig: cykloalcanos: egenskaper, reaktioner, användningar, exempelBåda strukturerna inträffar ständigt, så kol upprätthåller en konstant brist på elektroner; Det vill säga för katjoner som är mycket nära det kommer de att uppleva en elektrostatisk avstötning. Men om det är en anjon eller en art som kan donera elektroner kommer det att känna en stark attraktion för detta kol.
Det som sedan kallas den nukleofila attacken inträffar, vilket kommer att förklaras i ett nästa avsnitt.
Nomenklatur
När en förening har gruppen C = O sägs det att det är karbonyl. Beroende på karaktären av karbonylföreningen har den således sina egna nomenklaturregler.
Även om alla, oavsett vad som är, delar alla en regel gemensamt: C = O har en prioritering i den kolsyrade kedjan vid tidpunkten för att lista kolatomer.
Detta innebär att om det finns konsekvenser, halogenatomer, kvävefunktionella grupper, dubbla eller trippelförbindelser, kan ingen av dem ha ett mindre antal än C = O; Därför börjar den längsta kedjan listas så nära karbonylgruppen som möjligt.
Om det tvärtom finns flera C = eller i kedjan, och en av dem är en del av en funktionell grupp av större hierarki, kommer karbonylgruppen att ha en större lokaliserare och kommer att nämnas som en OXO -substituent.
Och vad som sägs hierarki? Följande, från högsta till mindre:
-Karboxylsyror, rcooh
-Ester, rcoor '
-Amida, rconh2
-Aldehyd, RCOH (eller RCHO)
-Cetona, rcor
Byte av R och R 'med molekylsegment, oändliga karbonylföreningar representerade av familjer ovan: karboxylsyror, estrar, amidas, etc. Var och en har associerat sin traditionella nomenklatur eller IUPAC.
Reaktivitet
Nukleofil attack
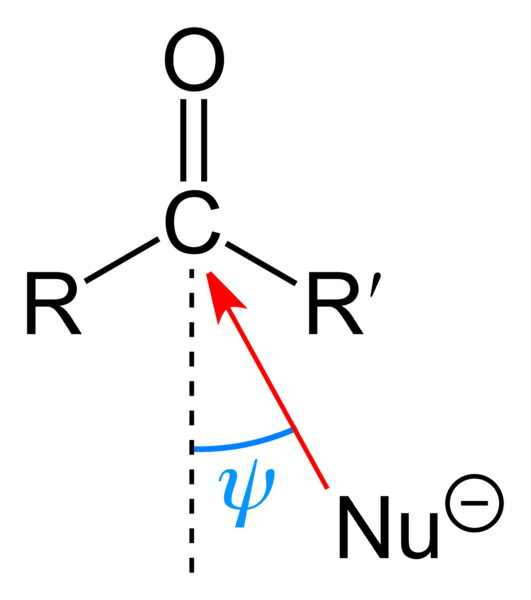 Nukleofil attack på karbonylgruppen. Källa: Benjah-Bmm27 [Public Domain]
Nukleofil attack på karbonylgruppen. Källa: Benjah-Bmm27 [Public Domain] Den övre bilden visar den nukleofila attacken som karbonylgruppen lidit. Nukleofilen, nu-, Det kan vara en anjon eller en neutral art med tillgängliga elektroner; Som ammoniak, nh3, Till exempel. Detta ser uteslutande till kol eftersom det enligt resonansstrukturer ger en positiv partiell belastning.
Positiv belastning lockar Nu-, som kommer att försöka närma sig en "flank" så att det finns det minsta steriska hinder av substituenterna r och r '. Beroende på hur skrymmande de är eller storleken på samma nu-, Attacken kommer att inträffa i olika vinklar ψ; Det kan vara mycket öppet eller stängt.
När attacken inträffar kommer en mellanhandsförening att bildas, nu-cr'-o-; Det vill säga syre stannar hos ett par elektroner för att tillåta NU att läggas till- till karbonylgruppen.
Detta negativt laddade syre kan ingripa i andra steg i reaktionen; Proton som en hydroxylgrupp, OH, eller släpp som en vattenmolekyl.
Kan tjäna dig: partitionskoefficient: distribution, distribution, applikationerDe involverade mekanismerna, liksom produkterna från reaktionen som erhålls genom denna attack, är mycket varierande.
Derivat
Den nublyic agenten nu- Det kan vara många arter. För varje specifik för att reagera med karbonylgruppen, olika derivat.
Till exempel, när nämnda nukleofila medel är en amin, NH2A, Iminas har sitt ursprung, r2C = nr; Om det är hydroxylamin, NH2Åh, resulterar i oximas, rr'c = noh; Om det är cyanidanjonen, CN-, Cianohydrinas, rr'c (OH) CN, och därmed med andra arter.
Minskning
Först sades det att denna grupp är syresatt och därför rostig. Detta innebär att med tanke på förhållandena kan länkar minskas eller förlora syreatomen ersätta den med hydrogener. Till exempel:
C = o => ch2
Denna transformation indikerar att karbonylgruppen reducerades till en metylengrupp; Det var väteförstärkning på grund av syreförlust. I mer lämpliga kemiska termer: karbonylföreningen reduceras till en alkan.
Om det är en cetona, rcor ', i närvaro av hydaracina, h2N-nh2, och en starkt grundläggande miljö kan reduceras till dess respektive alkan; Denna reaktion kallas Wolff-Kishner-reduktion:
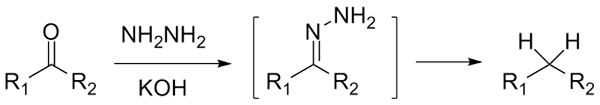 Wolff-Kishner reduktion. Källa: Jü [CC0]
Wolff-Kishner reduktion. Källa: Jü [CC0] Om å andra sidan reaktionsblandningen består av amalgamat zink och saltsyra, kallas reaktionen som Clemmensen -reduktion:
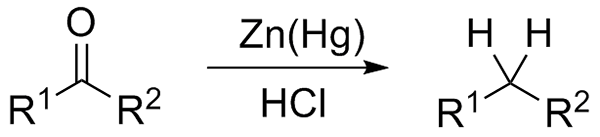 Clemmensen Reduction. Källa: Wikimedia Commons.
Clemmensen Reduction. Källa: Wikimedia Commons.
Acetal- och ceal -träning
Karbonylgruppen kan inte bara lägga till nukleofila medel nu-, Men under syraförhållanden kan det också reagera med alkoholer genom liknande mekanismer.
När en aldehyd eller cetona delvis reagerar med en alkohol, hemiacetaler eller hemiketaler har sitt ursprung. Om reaktionen genomförs helt är produkterna acetaler och ketaler. Följande kemiska ekvationer sammanfattar och klargör det nyligen nämnda:
Rcho + r3Oh g rchoh (eller3) (Hemiacetal) + r4Oh g rch (eller3) (Eller4) (Acetal)
Rcor2 + R3Oh g rcor2(OH) (eller3) (Hemical) + r4Oh g rcor2(Eller3) (Eller4) (ketal)
Den första reaktionen motsvarar bildningen av hemiacetaler och acetaler från en aldehyd, och den andra av hemiketaler och ketaler från en keton.
Dessa ekvationer är inte tillräckligt enkla för att förklara bildningen av dessa föreningar; Men för en första tillvägagångssätt för ämnet räcker det för att förstå att alkoholer läggs till och att deras sidokedjor r (r (r (3 och r4) De är kopplade till karbonylkol. Det är därför eller eller3 och eller4 Till den ursprungliga molekylen.
Den största skillnaden mellan en acetal och ketal är närvaron av väteatomen kopplad till kol. Observera att ketonen saknar detta väte.
Grabbar
Mycket lika som förklaras i nomenklaturen för karbonylgruppen, dess typer är baserade på vad som är substituenterna A och B, eller R och R '. Därför finns det strukturella egenskaper som delar en serie karbonylföreningar utöver bara ordningen eller typen av länkar.
Till exempel nämndes till principen om analogi mellan denna grupp och kolmonoxid, C≡O. Om molekylen saknar väteatomer och om det också finns två C = O -terminaler, kommer det då att vara en koloxid, CnANTINGEN2. För n lika med 3 kommer du att ha:
Kan tjäna dig: isóbarosO = c = c = c = o
Vilket är som om det fanns två C≡O -molekyler kopplade och separerade med ett kol.
Karbonylföreningar kan inte bara härledas från CO -gas, utan också från kolsyra, h2Co3 eller OH- (C = O) -OH. Här representerar de två OH R och R ', och ersätter endera av dem, eller deras hydrogener, erhålls karbononsyraderivat.
Och sedan finns det derivat av karboxylsyror, RCOOH, erhållna genom att ändra R -identiteter eller ersätta H med en annan atom eller kedja R '(vilket skulle ge upphov till en ester, Rcoor').
Hur man identifierar det i aldehydos och ketoner
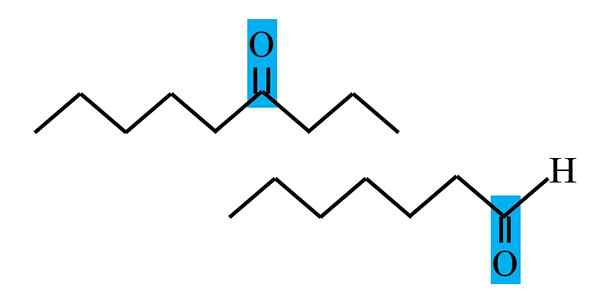 Differentiering av keton och aldehyd från en strukturell formel. Källa: Gabriel Bolívar.
Differentiering av keton och aldehyd från en strukturell formel. Källa: Gabriel Bolívar. Både aldehyd och ketoner har gemensamt närvaron av karbonylgruppen. Dess kemiska och fysiska egenskaper beror på det. Deras molekylära miljöer är emellertid inte lika i båda föreningarna; I den förstnämnda är han i terminalposition, och i sekunderna, var som helst i kedjan.
Till exempel är karbonylgruppen i den övre bilden inne i en blåaktig låda. I ketoner, bredvid denna låda måste det finnas ett annat kol- eller kedjesegment (upp och ner); Medan i aldehyderna kan det bara finnas en väteatom (nedan).
Om C = O är i ena änden av kedjan kommer det att vara en aldehyd; Det är det mest direkta sättet att skilja det från en Cetona.
Id
Men hur man vet experimentellt om en okänd förening är en aldehyd eller en keton? Det finns många metoder, från spektroskopisk (infraröd strålningsabsorption, IR) eller organiska kvalitativa tester.
När det gäller kvalitativa uppsatser är dessa baserade på reaktioner som när man ger positivt kommer analytiker att observera ett fysiskt svar; En färgförändring, värmeutsläpp, bubbelbildning, etc.
Till exempel, vilket lägger till provet en syralösning av k2Cr2ANTINGEN7 Aldehyden transformeras till karboxylsyra, vilket gör att lösningen på lösningen ändras från orange till grönt (positivt test). Samtidigt reagerar ketonerna inte, och därför observerar inte analytiker någon färgförändring (negativt test).
En annan rättegång är att använda Tollens -reagenset, [AG (NH3)2]+, så att aldehyden minskar katjonerna+ till metallsilver. Och resultatet: bildandet av en silverspegel längst ner i provröret där provet placerades.
Huvudexempel
Slutligen kommer en serie exempel på karbonylföreningar att listas:
-Ch3COOH, ättiksyra
-Hcooh, myrsyra
-Ch3Spetsa3, Propanon
-Ch3Spetsa2Ch3, 2-butanon
-C6H5Spetsa3, acetofenon
-Ch3Cho, etanal
-Ch3Ch2Ch2Ch2Cho, Pentanal
-C6H5Cho, bensaldehyd
-Ch3Conh2, acetamid
-Ch3Ch2Ch2Cooch3, Propylacetat
Nu, om exempel på föreningar citeras som helt enkelt har denna grupp, skulle listan vara nästan oändlig.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Reid Danielle. (2019). Carbonyl Group: Egenskaper och översikt. Studie. Återhämtat sig från: studie.com
- Sharleen Agvateesiri. (5 juni 2019). Karbonylgruppen. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wiki Kids Ltd. (2018). Karbonylföreningar. Återhämtad från: helt enkelt.Vetenskap
- Toppr. (s.F.). Nomenklatur och struktur i karbonylgruppen. Återhämtat sig från: toppr.com
- Clark j. (2015). Oxidation av aldehyder och ketoner. Återhämtat sig från: Chemguide.co.Storbritannien

