Hexano (C6H14) Fysiska och kemiska egenskaper, struktur, användning, toxicitet
- 2504
- 69
- Erik Eriksson
han hexan Det är ett kolväte som kännetecknas av att vara en organisk förening vars kondenserade kemiska formel är C är6H14. Det är en färglös, transparent vätska, som inte kan blandas med vatten. Den presenterar fem isomerer, den linjära är en av de viktigaste paraffiniska kolvätena i branschen och forskning.
Hexan erhålls genom fraktionerad destillation av råolja. Det är också naturligt närvarande i citrusfrukter och flyktiga fraktioner av olika växter eller frukter som äpple, guava, rostade hasselnötter, sötpotatis och salvia.
 N-hexanmolekyl. Källa: Benjah-Bmm27 [Public Domain]
N-hexanmolekyl. Källa: Benjah-Bmm27 [Public Domain] Det är en mycket brandfarlig flyktig vätska som finns i bensin, snabbt torkande lim och i gnidning av cement. Hexan används som ett lösningsmedel i processen för extraktion av vegetabiliska oljor, samt lipider och fetter som finns i förorenade vatten och jordar.
Människor som är professionellt utsatta för hexano, kan uppleva skador på det perifera nervsystemet, manifesteras av stickningar och ben i benen och armarna; Förutom generaliserad muskelsvaghet och, i allvarliga fall, atrofi av skelettmusklerna.
[TOC]
Fysiska och kemiska egenskaper hos hexer
Fysiskt utseende
Färglös, transparent och mycket flyktig vätska.
Molmassa
86,178 g/mol
Lukt
Bensin liknande
Lukttröskel
1,5 ppm
Densitet
0,6606 g/ml
Smältpunkt
-96 till -94 ºC
Kokpunkt
68,5 till 69,1 ºC
antändningspunkt
-22 ºC (stängd kopp).
Vattenlöslighet
9,5 mg/L (praktiskt taget oblandbart med vatten)
Löslighet i lösningsmedel
Mycket löslig i etanol, löslig i etyleter och kloroform. Belopp med alkohol, kloroform och eter.
Relativ täthet av ånga med luft
2,97 (luft = 1)
Oktanol/vattenpartitionskoefficient
Log P = 3 764
Ångtryck
17,60 kPa vid 20 ºC
Våglängd av maximal optisk densitet
200 nm
Det kan tjäna dig: Niobio (NB): Struktur, egenskaper, användningar, erhållningBrytningsindex
1 375
Gegga
0,3 MPa · s
Kaloriförmåga
265.2 J · K-1· Mol-1
Förbränningsvärme
4.163,2 kJ · mol-1
Förångningsvärme
31,56 kJ · mol-1
Ytspänning
17,89 mn/m a 25 ºC
Joniseringspotential
10,18 eV
Stabilitet
Stabil. Oförenlig med oxiderande medel, klor, fluor, magnesiumperklorat. Bildar en explosiv blandning med luften.
Reaktivitet
Hexan kan reagera kraftigt med oxiderande material, som kan inkludera flytande klor, koncentrerat syre, natriumhypoklorit och kalciumhypoklorit. Det är också oförenligt med dyitrogentetroxid. Hexan kan attackera vissa former av plast, gummi och beläggningar.
Hexanstruktur
Intermolekylär interaktioner
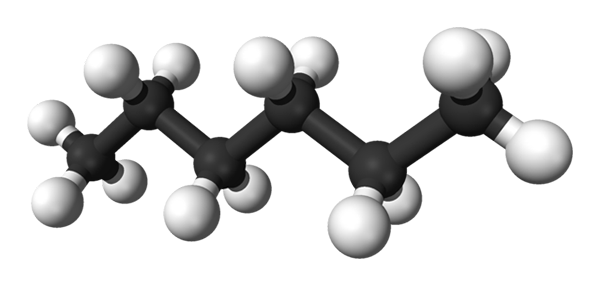
Den första bilden visar molekylen för n-Hexan representerad av en modell av sfärer och staplar. De svarta sfärerna motsvarar kolatomer och komponerar det sicksackande kolskelettet, medan de vita sfärerna är väteatomer. han n-Hexano är därför ett kolväte, linjärt och mycket dynamiskt.
Eftersom alla dess C-H-länkar är låg polaritet, saknar molekylen dipolmomentet. På så sätt är dess intermolekylära interaktioner inte av dipol-dipolen.
Varje molekyl av n-Hexano "passar" en ovanpå den andra vid mycket låga temperaturer, som det skulle antas i sin kristallina struktur. Å andra sidan, i vätskan flexar deras skelett och roterar sina C-H-bindningar, och härstammar att den nämnda vätskan är flyktig och kokar vid 68,7 ºC.
Isomerer
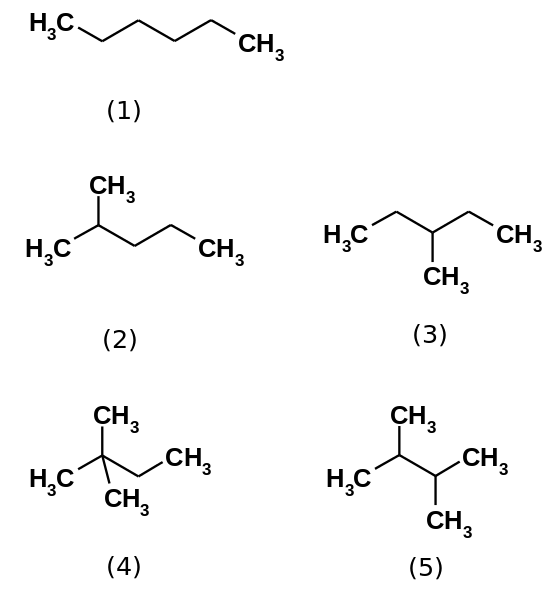 De fem hexanisomererna. Källa: Steffen 962 [Public Domain]
De fem hexanisomererna. Källa: Steffen 962 [Public Domain] Hexan kolväte består faktiskt av fem isomerer, är den n-Hexan den minst grenade, (1). De andra fyra isomererna är i ökande ordning:
2-metylpropan (2)
3-metylpropan (3)
2,2-dimetylbutan (4)
2,3-dimetylbutan (5)
Observera att strukturerna blir mer grenade från (1) till (5). Att vara mer grenad minskar spridningskraften, eftersom det inte längre finns linjära delar som läker effektivt. Detta leder till en minskning och variation av isomers kokpunkter; Även om vissa acceptabla avvikelser observeras.
Kan tjäna dig: Vad är Erristeneo?Båda 2-metylpropan. Sedan följs den av 2,3-dimetylbutan (PEB = 58 ºC), för att äntligen placera 2,2-dimetylbutan som den mest flyktiga vätskan (PEB = 49,7 ºC).
Ansökningar
Hexan blandas med liknande kemikalier för att producera lösningsmedel. Bland de namn som dessa lösningsmedel får är kommersiella hexan, blandade hexaner etc. De används som rengöringsmedel inom textilindustrin, möbler och ihålig tryckning.
Hexan är en ingrediens i limet som används vid vattentätning av tak, i skor och läder. Det används också för att binda böcker, för att forma piller och surfplattor, spola, göra däck och baseballbollar.
Hexan används för att bestämma mineralbristindex och fylla vätska för termometrarna istället för kvicksilver; Generellt med ett rött eller blått färgämne. Det används också vid utvinning av fett och vattenolja för analys av dess föroreningar.
Hexano används som lösningsmedel i extraktionen av växtfröolja, såsom sojabönor, raps eller bit. Dessutom används det för att avbryta bitar av olika ursprung. Det används i alkohol denaturering, i HPLC -analysmetoden och spektrofotometri.
Giftighet
Inandning och kontakt
Den akuta toxiciteten hos hexan är relativt låg, även om den är en mild bedövning. Akut exponering för höga hexankoncentrationer kan producera genom inandning, mild depression av centrala nervsystemet (CNS), som manifesteras av yrsel, svindel, mild illamående och huvudvärk.
Kan tjäna dig: endoterm reaktionDet kan också orsaka dermatit och irritation i ögonen och halsen. Kronisk hexan inandning, relaterad till arbetsaktivitet, kan orsaka skador på det perifera nervsystemet (sensomotorisk polyneuropati).
Inledande symtom är stickningar och benkramper och armar, följt av muskelsvaghet. I svåra fall kan det finnas en atrofi av skelettmuskler, tillsammans med förlust av samordning och synproblem.
Hexantoxicitet är relaterad till genereringen av hexan-2,5-diona metabolit. Detta reagerar med aminosyran lysin i en protein sidokedja, vilket ger förlust av proteinfunktion.
Säker dos
Enviromental Protection Agency (EPA) beräknade en referenskoncentration (RFC) för 0,2 mg/m hexan3, och en referensdos (RFD) på 0,06 mg/kg vikt/dag.
På 1960- och 1970 -talet. Orsaken var att de andade in en atmosfär av hexan på 500 - 2.500 ppm, i 8-14 timmar per dag.
Arbetarna presenterade de kända symtomen på den kroniska inandningen av hexano och upptäckte läkarna att nerverna som kontrollerade musklerna i armar och ben skadades.
Referenser
- Danielle Reid. (2019). Hexan: struktur, formel och egenskaper. Studie. Återhämtat sig från: studie.com
- Nationellt centrum för bioteknikinformation. (2019). Hexan. Pubchemdatabas. CID = 8058. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Hexan. Hämtad från: i.Wikipedia.org
- Molekylernas värld. (s.F.). Hexanmolekyl. Återställt från: Worldofmolecules.com
- Kemisk bok. (2017). Hexan. Återhämtat sig från: Chemicalbook.com
- Commonwealth of Australia. (s.F.). N-hexan: källor till utbildningar. Återhämtat sig från: npi.Gov.Au
- Epa. (2000). Hexan. [Pdf]. Återhämtat sig från: EPA.Gov
- Byrå för giftiga ämnen och sjukdomsregister. (1999). Pub Pub Health Statement för N-Hexan. Hämtad från: ATSDR.CDC.Gov
- « 5 kemiska reaktioner experiment (enkla och säkra)
- Toronjil -egenskaper, livsmiljöer, egenskaper, odling, vård »

