Hydrazinstruktur, egenskaper, syntes, användningar

- 1228
- 120
- Erik Eriksson
De Hydrazin Det är en oorganisk förening vars kemiska formel är n2H4. Det består av en medlem av familjen av kvävehydror, det enklaste är det enklaste av allt. Även om dess molekyl verkar enkelhet, uppvisar den flera kemiska och fysiska egenskaper som gör hydrazin till ett intressant och energiskt lovande ämne.
Håll en nära likhet med vatten, eftersom båda finns som flytande ämnen i liknande temperaturintervall. Från hydrazin kan vi få organiska derivat genom att ersätta dess hydrogener med kolsyrade grupper. Från den syntetiserade hydrazoner, hydrazider och hydrazinsalter.
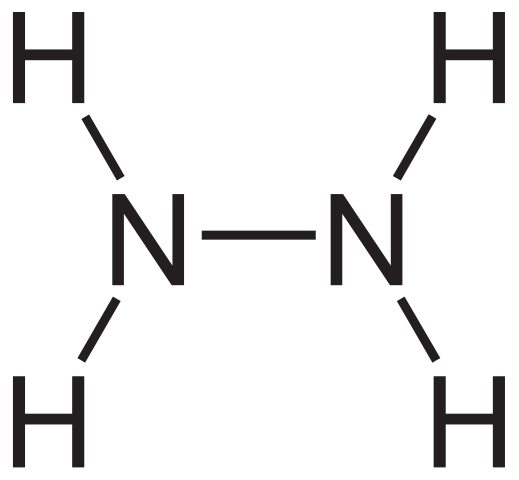 Hydrazinstrukturformel. Källa: Neurotoger via Wikipedia.
Hydrazinstrukturformel. Källa: Neurotoger via Wikipedia. Den strukturella formeln för hydrazin kan ses ovan, som kan skrivas som h2Nnh2 eller h2N-nh2. Om du tittar noggrant verkar det som om två NH -molekyler3 De skulle ha kopplat till varandra. I bildningen av N-N-länken är emellertid inte bara ammoniakmolekyler som reagens involverade.
Hydrazin är en förening som har flera tillämpningar, eftersom det är en utmärkt föregångare för symfiner av föreningar, både organiska och oorganiska. På samma sätt, tack vare dess reducerande kraft och dess sönderdelningsprodukter, är den avsedd att eliminera syre och andra gaser, få ädelmetaller; Och särskilt för att öka rymdskeppet och tillståndet -konstflygplan.
[TOC]
Hydracinstruktur
Molekyl och länk
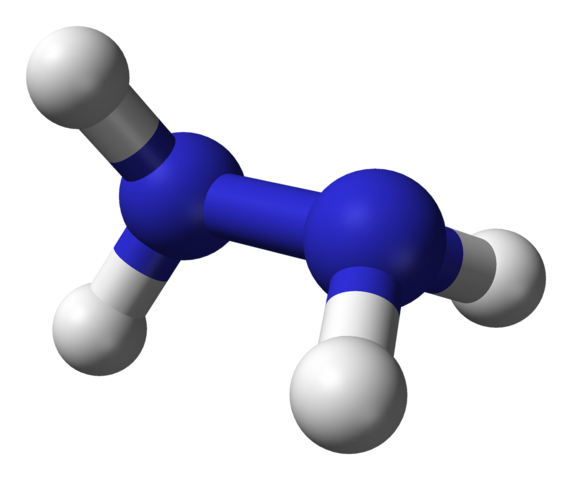 Hydrazinhydrazin. Källa: Ben Mills via Wikipedia.
Hydrazinhydrazin. Källa: Ben Mills via Wikipedia. I den övre bilden har vi den hydrazinmolekylen representerad av en sfärer och staplarmodell. Observera att den rumsliga orienteringen av väteatomer, vita sfärer, står i kontrast till det intryck som den strukturella formeln erbjuder; det vill säga hydrogener för båda -NH2 De är inte inriktade eller förmörkade, men har en rotationsvinkel på 95 ° med varandra.
I själva verket är det så mycket att N-N-länken knappt kan rotera, med en energibarriär som måste löpa ut för att förmörka de fyra väteatomerna.
Vad handlar det här om? I princip, till starka elektroniska avvisningar som ömsesidigt upplever de två par av ensamma elektroner på kväveatomer. Denna 95º -vinkel är den som ger hydrazinmolekylen den största stabiliteten.
Kan tjäna dig: litiumbromid: struktur, egenskaper, användningar, riskerGeometrier
Varje kväveatom har en SP -hybridisering3, Anta en triangulär pyramidgeometri. Därför kunde hydracinmolekylen såsom två pyramider med de fria elektronparen som två pyramider kopplade till en av dess vertikaler och i vars centra kväveatomerna skulle vara belägna.
Intermolekylär interaktioner
Formeln h2Nnh2 Jag kunde ge den falska idén att hydrazin är en apolär förening för att ha två lika grupper kopplade. Men molekylstrukturen och dess roterade N-N-bindning visar att molekylen inte är helt symmetrisk, och nämner också att deras fria elektronpar inte pekar i motsatta riktningar.
Detta innebär att hydrazin, som är strukturellt och elektroniskt asymmetrisk, presenterar ett dipolmoment. Och därför interagerar deras molekyler med varandra genom dipol-dipol2Nnh2-Nh2Nh2, som är ansvariga för att hydrazin har en mycket hög kokpunkt.
Hydracinegenskaper
 Hydrazinhydrat. Källa: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
Hydrazinhydrat. Källa: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Fysiskt utseende
Hydrazin är en färglös vätska som liknar vatten när det gäller viskositet och densitet. När de bränner avger den vita ångor, förutom att få ammoniak och fisk.
Molmassa
32.0452 g/mol
Smältpunkt
2 ºC.
Kokpunkt
114 ºC. Observera att hydrazin finns i ett flytande tillstånd inom temperaturintervallet 2-114 ºC, mycket lik den för vatten, 0-100 ºC.
Densitet
1.021 g/cm3
Ångtäthet
1.1 i luftförhållandet.
Ångtryck
Runt 0.010 atm vid 30.7 ºC
Löslighet
Hydrazin är blandbar med vatten såväl som med flera primära alkoholer. Hydrazin bildar ett hydrat med vatten, n2H4· H2Eller, som kännetecknas av att vara tätare än ren eller vattenfri hydrazin. Detta hydrat är den mest marknadsförda produkten, eftersom den är mer stabil och billig.
Dipolärt ögonblick
1.85 D. Det är en ganska polär substans, nästan samma som vatten.
Det kan tjäna dig: Yodiumsyra (HIO3): Struktur, egenskaper, risker och användningarGegga
0.876 CP
Flashpoint
52 ºC
Självriktningstemperatur
Varierar beroende på ämnen eller ytor som den kommer i kontakt. Till exempel, på järnoxider bränner vid 23 ° C, medan på glas eller andra behållare börjar inte bli inflammerade förrän 270 ºC.
Sönderfall
När den brinner i luften sönderdelas den i kväveoxider, nejx. Men när det gäller dess katalytiska sönderdelning, det vill säga som accelereras av metalloxider eller metall, produkter som ammoniak, kväve och väte erhålls och en enorm mängd värme, som slutar bilda en brinnande men osynlig låga.
Reaktivitet
Hydrazin är ett bra reducerande medel, eftersom när oxiderat producerar vatten och kväve, båda föreningar som inte lider sekundära reaktioner.
Å andra sidan är hydrazin en nukleofil, eftersom den använder sina fria elektronpar för att gå med andra organiska molekyler. På samma sätt kan det drabbas av3, För att producera metylerade derivat: ch3Nhnh2 eller (ch3)2Nnh2.
Reagerar med starka syror för att bilda Hidrazinio -salter, n2H5X, och från Hidrazonio, n2H6X2. De senare är de minst vanliga. Hydraziniumsulfat, [N2H5] Hso4, Den framställs genom att reagera hydrazinhydrat med svavelsyra.
Basicitet
Hydrazin är en svagare bas än ammoniak:
N2H4(Ac) + h2Eller (l) ⇌ n2H5+(AC) + OH-(Ac)
Kb = 1.3 · 10-6
Detta beror på att hydrazinio konjugatsyra2H5+ eller h3N+-Nh2, har sin last destabiliserad av NH -gruppens attraktoreffekt2; det vill säga istället för att tillhandahålla elektronisk densitet till positivt kväve, tillbakadragande.
Hydrazin kan drabbas av en andra, mycket mindre trolig protonation, som genererar en ännu mer instabil konjugerad syra:
N2H5+(Ac) + h2Eller (l) ⇌ n2H6+(AC) + OH-(Ac)
Kb = 8.4 · 10-16
Hydrazonium, n2H6+ eller h3N+-N+H3, Det är mycket instabilt på grund av avvisningarna mellan de positiva belastningarna av båda kväveatomerna. Men i sällskap med vissa anjoner kan det existera som ett salt.
Giftighet
Anhydra hydrazin är en extremt giftig, kaustisk och eventuellt cancerframkallande substans, för att inte tala om att det är mycket explosivt, så det bör bara manipuleras under strikta säkerhetsprotokoll.
Kan tjäna dig: Kompressibilitetsfaktor: Hur man beräknar, exempel och övningarSyntes
Den mest använda metoden för att syntetisera hydrazin är Raschig -processen. Detta består av följande två reaktioner:
Nh3(AC) + NaOCl (AC) → NH2Cl (AC) + NaOH (AC)
2Nh3(AC) + NH2Cl (ac) → n2H4(AC) + NH4Cl (ac)
I slutändan bildas hydratet N2H4· H2Eller, som destilleras i närvaro av KOH eller NaOH som torra fasta ämnen:
N2H4· H2O → n2H4
På detta sätt erhålls anhydra-hydrazinen och N-N-länken bildas.
Hydrazinanvändning
 Hydrazin är ett av de mest uppskattade ämnena i flyg- och rymdboomen. Källa: Pxhere.
Hydrazin är ett av de mest uppskattade ämnena i flyg- och rymdboomen. Källa: Pxhere. - Hydrazin, i närvaro av metalliska katalysatorer, bryts exotermiskt ned för att producera kväve och väte, vilket ger tillräckligt med energi för att öka flygplan, raketer och satelliter.
- Denna tendens att bryta ner och orsaka gaser används exakt för att blåsa upp polymermaterial, såsom gummi eller polyeten, vilket förvandlar dem till sina respektive skum.
- På samma sätt, genom att frigöra gaser, kan dessa dra andra som löses i rör från rören, så det är mycket användbart att eliminera syre från pannor och därmed undvika att de korroderar.
- Hydrazin är ett föregångsmaterial för många organiska föreningar med farmakologiska funktioner, antifungicider, herbicider, insekticider, gödselmedel etc. Detta beror på att det är en mängd olika cykliska kvävederivat syntetiserade.
- Slutligen, att vara ett bra reducerande medel, används hydrazin och dess hydraziniumsalter för att minska ädelmetallmineraler, vilket är av stort värde i den metallurgiska industrin.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Hydrazin. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Hydrazin. Pubchem Comunund -sammanfattning för CID 9321. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Redaktörerna för Enyclopaedia Britannica. (2020). Hydrazin. Britannica Encyclopaedia. Återhämtat sig från: Britannica.com
- Iridium nästa. (20 juni 2017). Hydrazin - giftigt för människor, men satelliter älskar det. Återhämtat sig från: iridium.com

