Omättade kolväten
- 2020
- 11
- PhD. Lennart Johansson
Vi förklarar vad omättade kolväten, deras klassificering, egenskaper, nomenklatur och ger flera exempel är
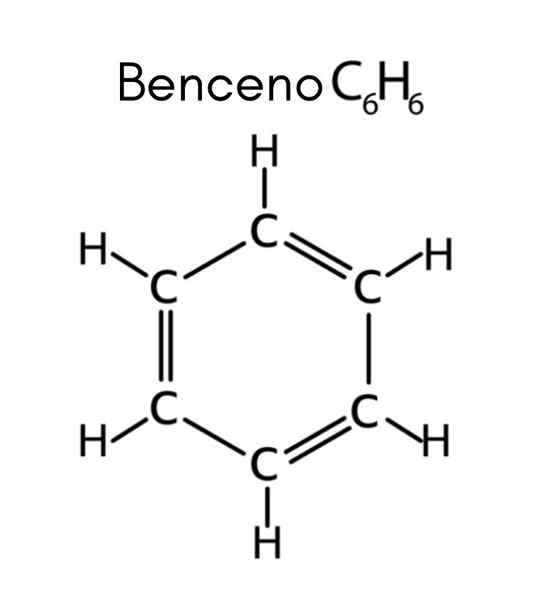
 Benzen är ett exempel på omättat kolväte
Benzen är ett exempel på omättat kolväte Vad är omättade kolväten?
De omättade kolväten De är organiska föreningar som endast bildas av kol och väte, som har en eller flera flera bindningar mellan kolatomer. Detta innebär att alla formel C -föreningxHoch som presenterar en dubbel eller en trippelbindning är ett omättat kolväte.
Omättade kolväten bildas av alkener och alkiner samt aromatiska föreningar. Anledningen till att de är omättade är att de har ett mindre antal hydrogener än det maximala de kunde ha, med tanke på antalet kolatomer i strukturen.
Omättade kolväten erkänns genom att ha mindre än 2N+2 -hydrogener (vilket är det maximala antalet hydrogener som kan vara kol), där N är antalet kolatomer i molekylformeln.
Ett exempel på omättat kolväte är buteno, vars molekylformel är c4H8. Det maximala antalet väten för 4 kol skulle vara 2 (4) +2 = 10 väten. Detta motsvarar antalet hydrogener i ett mättat kolväte. Eftersom Buteno bara har 8 hydrogener, som är mindre än 10, är det ett omättat kolväte.
Antalet omättningsområden
Omättade kolväten kännetecknas av antalet omättnad. Detta indikerar antalet vätepar som är mindre än ett omättat kolväte jämförs med ett mättat ett som har samma antal kolhydrater.
Antalet omättning kan beräknas för alla omättade föreningar med hjälp av följande formel:
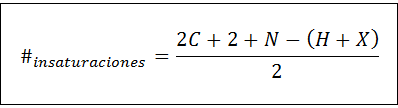
Där C, N, H och X representerar antalet kol, nitrogener, hydrogener och halogener i molekylformeln. Detta nummer ger oss en uppfattning om hur många dubblar eller trippelbindningar som har en förening, med tanke på dess molekylformel, även om man måste vara försiktig eftersom cykler (som inte är omättning) också bidrar till antalet omättnad:

Exempel
Benzen har formel C6H6, Så antalet omättnad är:
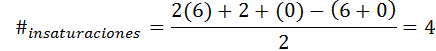
I detta fall motsvarar de fyra omättningen tre dubbla länkar och en cykel.
Klassificering av omättade kolväten
Enligt typen av kolväte
- Alkener: Det är de som har minst en dubbel länk i sin struktur.
- Alkynes: De är de som har minst en trippellänk i sin struktur.
- Aromatisk: De är cykliska fleromättade föreningar med speciella egenskaper som gör dem särskilt stabila.
Enligt kolkedjan
- Linjär: omättade föreningar där alla kolatomer är kopplade till varandra i en enda kedja.
- Förgrenad: De är de som har en huvudkedja och även flera sidokedjor som bildar förgreningar.
- Cyklisk: De är de där en stängd cykel av kolatomer presenteras där minst en dubbel eller trippelbindning presenteras (cykloalquenos, cykloalquinos och aromatiska).
Enligt antalet omättnad
- Enkelomättad: När de bara har en flera länkar, det vill säga det är en enda dubbelbindning eller en enda trippellänk.
- Polynsmättad: När strukturen har mer än en flera länkar, som i fallet med alkian, alkian, alkeniner, etc.
Egenskaper hos omättade kolväten
Egenskaperna för omättade kolväten beror starkt på den aktuella typen av kolväte i fråga:
Fusions- och kokpunkter
I allmänhet har omättade kolväten låg fusion och kokpunkter. Jämfört med alkaner har emellertid alkener med samma antal kol och liknande huvudkedja vanligtvis en lägre kokpunkt, medan alkiner tenderar att ha större kokpunkter.
Detsamma gäller för fusionspunkter. I följande tabell kan man se att både fusionspunkten och kokningen av 1-penten är lägre än Pentan och dessa som de i 1-Pentino.

Fysiskt tillstånd
På grund av dess låga smält- och kokpunkter tenderar omättad låg molekylvikt viktvikt kolväten tenderar att vara gasformiga vid rumstemperatur. Många är också flytande och de med större molekylvikt är solida. I många fall är fasta ämnen amorfa fasta ämnen istället för kristallina.
Polaritet
Alla kolväten, inklusive omättade, är apolära föreningar, eftersom kolelektronegativitet och väte är mycket lika. Det enda undantaget är i fallet med terminala alkiner2 och sp3.
Löslighet
Som apolära är omättade kolväten olösliga i vatten och andra polära lösningsmedel, men de är mycket lösliga i apolära lösningsmedel som koltetraklorid, cyklohexan och andra. I själva verket är många av dessa föreningar i sig själva apolära lösningsmedel.
Det kan tjäna dig: disposio: struktur, egenskaper, erhålla, användningarDe är bränslen
Ett kännetecken för alla kolväten, inklusive omättade, är att de förbränner i närvaro av syre för att bli koldioxid och vattenfrisättning av energi i form av ljus och värme.
De kan polymerisera
Genom olika kemiska reaktioner kan alkener och alkiner gå med varandra för att bilda polymerer som i fallet med polyeten och polypropen, för att bara nämna några. Så omättade kolväten är utgångsmaterialet för många vanliga plast.
Kemisk reaktivitet
Reaktiviteten beror starkt på vilken typ av funktionell grupp som har en molekyl. När det gäller alkener och alkiner är dessa vanligtvis ganska reaktiva och kan drabbas av reaktioner av hydrering, hydrering, hydrohalogenering och andra typer av tilläggsreaktioner.
Å andra sidan är aromatiska föreningar vanligtvis ganska inerta eftersom de är mycket stabila. De karakteristiska reaktionerna hos dessa föreningar är de aromatiska elektrofila substitutionsreaktionerna.
Nomenklatur av omättade kolväten
Alkenens nomenklatur
Linjära alkener
Namnet på de linjära alkenerna är byggda genom att placera ett prefix som indikerar antalet kolatomer i kedjan, följt av kollokaliseringen där den separata dubbelbindningen börjar med skript från resten av namnet och slutfört med suffixet _eno:
Prefix-lokaliserare
- Exempel:
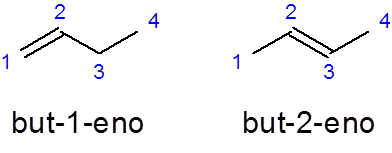
han But -1 -no Det är namnet på den linjära butenen med en dubbelbindning i det första kolet medan But-2-Nine Den har dubbelbindningen i det andra kolet.
Grenade alkener
I fallet med grenade alkener väljs den längsta huvudkedjan som innehåller båda dubbelbindningskolan och prioritet till dubbelbindningen är numrerad. Namnet byggs först genom att placera konsekvenserna i alfabetisk ordning som föregås av dess lokaler följt av namnet på huvudkedjan som anges ovan.
- Exempel:
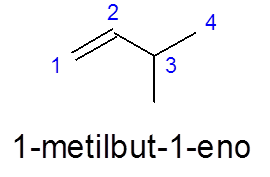
I 3-metylbut-1 -en görs numreringen från vänster till höger för att prioritera dubbelbindningen, istället för att prioritera grenning (metylgruppen).
Polyener
När det gäller fleromättade eller polienösa alkener, som innehåller mer än en dubbelbindning, väljs det största möjliga antalet dubbelbindningar som huvudkedjan, oavsett om det finns andra längre kedjor.
I namnet på huvudkedjan läggs en lokalisering till för varje dubbelbindning och prefixet di, tri, tetra, etc. före avslutningen -eno, för att ange antalet dubbla länkar du har.
- Exempel:
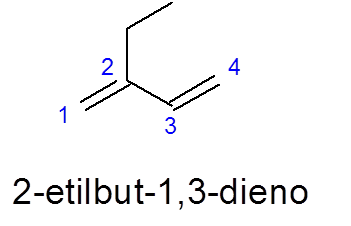
Observera i detta fall att trots att det finns en längre 5 -kolkedja väljs 4 av 4, eftersom den innehåller de två dubbla länkarna.
Alquinos nomenklatur
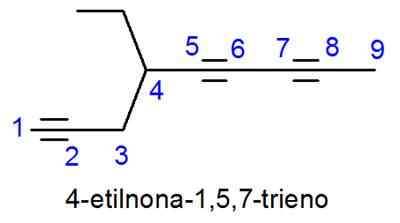
Alkynes kallas mycket lik Alkenes, med den enda skillnaden att namnet slutar i -ino istället för -eno. I fall där det finns mer än en trippellänk placeras lokaliserna för dem alla och det numeriska prefixet som indikerar hur många det finns.
- Exempel:
Nomenklatur av aromatiska föreningar
Aromatiska kolväten utses till bensenderivat och både numrering och vägen för att namnge dem beror på hur många substituenter ringen har.
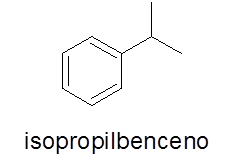
Aromatiska ringar med en enda substituent
I det här fallet är det inte nödvändigt. Namnet består av namnet på grenen följt av ordet bensen.
- Exempel:
Aromatiska ringar med två substituenter
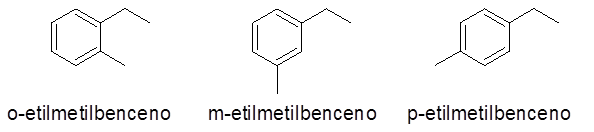
I detta fall kan 3 siffror eller ersättningsmönster ges (1.2), (1.3) och (1,4). Eftersom det är likgiltigt att ange vilken ersättning som är i kol 1 och vilken i den andra, orto prefix (o-), meta- (m-) respektive para- (p-) för att hänvisa till samma.
- Exempel:
Aromatiska ringar med mer än 2 substituenter
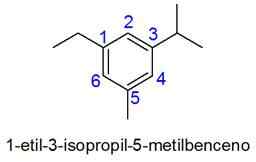
I detta fall väljs numreringen av den minsta kombinationen av lokaler. Om två siffror är lika, prioriteras substituenter enligt den alfabetiska ordningen.
- Exempel:
Exempel på omättade kolväten
Därefter presenteras ytterligare exempel på omättade kolväten för de som redan nämnts.
Acetylen (c2H2)
Acetylen är det vanliga namnet på Etino, den enklaste alkeminen. Denna förening har 2 omättnad på grund av sin trippellänk och används bland annat i stål- och svetsutrustningen.
Cyklohexen (c6H10)
6 -Carbon cyklisk alken som har två omättnad: en på grund av cykeln och den andra på grund av dubbelbindningen.
Stretch (c8H8)
Denna förening används vanligtvis i polymerer. Det är en aromatisk alken med 5 omättnad.

