Hydrolasasstruktur, funktioner, exempel

- 601
- 55
- Johan Johansson
De Hydrolas De är enzymer som ansvarar för att hydrolysera olika typer av kemiska länkar i många olika föreningar. Bland de viktigaste länkarna att hydrolyz är ester, glukosid- och peptidlänkar.
Inom gruppen av hydrolaser har mer än 200 olika enzymer klassificerats, grupperats minst 13 individuella uppsättningar; Dess klassificering är i huvudsak baserad på vilken typ av kemisk förening som fungerar som ett substrat.
 Grafisk modellering med bioinformatikverktyg i strukturen för ett hydrolas (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid
Grafisk modellering med bioinformatikverktyg i strukturen för ett hydrolas (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Hydrolaser är nödvändiga för matsmältningen i tarmen, eftersom de är ansvariga för att förnedra en stor del av länkarna som utgör de kolsyrade strukturerna i de livsmedel som de äter in.
Dessa enzymer fungerar i vattenhaltiga medier, eftersom de behöver vattenmolekyler runt dem för att lägga till föreningarna när molekylerna är uppdelade. Med enkla ord utför hydrolaser en hydrolytisk katalys av de föreningar som de verkar.
Till exempel när ett hydrolas bryter en C-C-kovalent bindning är resultatet vanligtvis en C-O-grupp och en C-H-grupp.
[TOC]
Strukturera
Liksom många enzymer är hydrolaser organiserade globulära proteiner i komplexa strukturer som är organiserade genom intramolekylära interaktioner.
Hydrolaser, som alla enzymer, binder till en eller flera substratmolekyler i en region i dess struktur som kallas "aktiv plats". Denna plats är en ficka eller klyftan omgiven av många aminosyrarester som underlättar greppet eller föreningen av underlaget.
Varje typ av hydrolas är specifik för ett givet substrat, som bestäms av dess tertiära struktur och av bildandet av aminosyror som gör deras aktiva plats. Denna specificitet höjdes didaktiskt av Emil Fischer som en slags "nyckel och lås".
Kan tjäna dig: polymeras: egenskaper, struktur och funktionerFör närvarande är det känt att substratet i allmänhet inducerar förändringar eller snedvridningar i bildningen av enzymer och att enzymer i sin tur snedvrider strukturen för substratet för att säkerställa att denna "spets" på dess aktiva plats.
Funktioner
Alla hydrolaser har den huvudsakliga funktionen att bryta kemiska bindningar mellan två föreningar eller inom strukturen för samma molekyl.
Det finns hydrolaser för att bryta nästan alla typer av länkar: vissa försämrar esterbindningarna mellan kolhydrater, andra peptidbindningar mellan proteinaminosyror, andra karboxylbindningar etc.
Syftet med den kemiska bindningsprocessen katalyserad av ett hydrolasenzym varierar avsevärt. SMOZYME, till exempel, ansvarar för hydrolysen av kemiska bindningar med organismskyddsändamål som syntetiserar det.
Detta enzym försämrar de länkar som håller tillsammans med föreningarna i cellväggen i bakterierna, med syftet att skydda människokroppen från bakteriell spridning och en möjlig infektion.
Nucleas är "fosfatas" -enzymer som har förmågan att försämra nukleinsyror, som också kan representera en cellförsvarsmekanism mot DNA- eller RNA -virus.
Andra hydrolaser, såsom de av "proteaser" -typen, försämrar peptidbindningarna av proteiner i matsmältningskanalen för att göra aminosyror tillhörande i mag -tarmepitelet.
Även hydrolaser är involverade i olika energiproduktionshändelser i cellmetabolism, eftersom fosfataser katalyserar frisättningen av fosfatmolekyler från högenergi -substrat såsom pyruvat, i glykolys.
Det kan tjäna dig: sojaböngreppExempel på hydrolasaser
Bland de stora mångfalden av hydrolaser som forskare har identifierat har vissa studerats med större tonvikt än andra, eftersom de är involverade i många väsentliga processer för cellliv.
Bland dessa är smidigheten, proteaserinen, endonukleous och glukosidas eller glykosyraeous fosfataser.
Smidigheten
Enzymer av denna typ avbrott. Detta hamnar vanligtvis med en total lysering av bakterierna.
Smozymer försvarar kroppen av djur av bakterieinfektioner och finns rik i kroppsutsöndringar i vävnader som är i kontakt med miljön, till exempel tårar, saliv och slemhinnor.
Det släta kycklingägget var den första proteinstrukturen som kristalliserades genom x -strålar. Denna kristallisation gjordes av David Phillips, 1965, vid London Real Institute.
Det aktiva stället för detta enzym består av asparagin-alanin-mekanin-peasagine-glycin-glycin-peragin-slätt-metioninpeptiden (NAM-NAG-NAM).
Proteaserin
Enzymerna i denna grupp är ansvariga för hydrolyserande peptidbindningar i peptider och proteiner. De mest studerade är trpsin och chimotripsin; Det finns emellertid många olika typer av proteaser, som varierar med avseende på substratets specificitet och dess katalysmekanism.
"Proteaserna" kännetecknas av att ha en serin -typ nukleofil aminosyra. Proteasas Serin kan också bryta ett brett utbud av esterlänkar.
Kan tjäna dig: vad är den kemiska sammansättningen av levande varelser?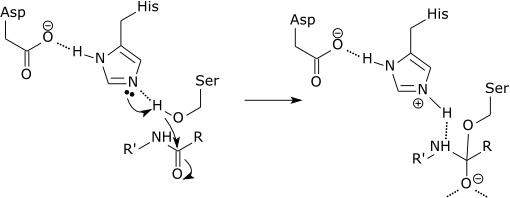 Grafiskt schema för verkan av ett proteas som bryter en peptidlänk i histidinaminosyran (källa: Zephyris på det engelska språket Wikipedia [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/)] via Wikimedia Commons)
Grafiskt schema för verkan av ett proteas som bryter en peptidlänk i histidinaminosyran (källa: Zephyris på det engelska språket Wikipedia [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/)] via Wikimedia Commons) Dessa enzymer klippte peptider och proteiner på ett ospecifikt sätt. Men alla peptider och proteiner som ska skäras måste bindas av den N-terminala änden av peptidlänken till enzymets aktiva ställe.
Varje kort proteas är exakt den amida-bindningen som bildas mellan den C-terminala änden av aminosyran i karboxyländen och aminersyraminen som är mot den N-terminala änden av peptiden.
Nukleasfosfataser
Dessa enzymer katalog. Det finns många olika typer av dessa enzymer, eftersom de är specifika för typen av nukleinsyra och skärplatsen.
 Grafiskt schema för verkan av en endonukleas som hydrolyserar en fosfodiésterbindning (källa: J3D3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Grafiskt schema för verkan av en endonukleas som hydrolyserar en fosfodiésterbindning (källa: J3D3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Endonukleaser är nödvändiga inom bioteknik, eftersom de tillåter forskare att modifiera genomens genomer genom att klippa och ersätta fragment av den genetiska informationen från nästan alla celler.
Endonukleaserna gör skärning av kväve baser i tre steg. Den första är genom en nukleofil aminosyra, sedan bildas en mellanhandstruktur med negativ belastning som lockar fosfatgruppen och slutligen bryter kopplingen mellan de två baserna.
Referenser
- Davies, g., & Henrissat, f. (nittonhundranittiofem). Strukturer och mekanismer för glykosylhydroler. Struktur, 3 (9), 853-859.
- Lehninger, a. L., Nelson, D. L., Cox, m. M., & Cox, M. M. (2005). Lehninger principer för biokemi. Macmillan.
- Mathews, a. P. (1936). Biokemi principer. W. Trä.
- Murray, r. K., Granner, D. K., Mayes, s., & Rodwell, V. (2009). Harpers illustrerade biokemi. 28 (s. 588). New York: McGraw-Hill.
- Ollis, D. L., Cheeah, e., Cygler, m., Dijkstra, b., Funow, f., Franken, s. M.,... & Sussman, J. L. (1992). Α/ß hydrolas vikning. Teknisk protein, design och urval, 5 (3), 197-211.

