Järnhydroxid (II) struktur, egenskaper, användningar
- 2513
- 357
- Per Eriksson
han järnhydroxid (ii), Även kallad järnhydroxid, det är en oorganisk förening av tros kemisk formel (OH)2. Om dess renhet är hög, består dess fasta endast av trosjoner2+ och åh- I ett 2: 1 -förhållande; Vattenmolekyler och olika joniska arter kan emellertid innehålla, ändra positionen.
Representerar den "reducerade" formen av den berömda rost, rödaktiga ytan som består av trosjoner3+; Medan han är i grönaktig rost dominerar tron2+, Bredvid OH- och en annan mängd anjoner: co32-, Sw42-, NEJ3- och haluros (f-, Kli-,… ), Till exempel. Resultatet, även om basen för denna gröna rost är tro (OH)2, är att olika fasta ämnen erhålls.
 Grön oxid på järnytan: källmaterial av denna typ av hydroxid. Källa: Pixabay.
Grön oxid på järnytan: källmaterial av denna typ av hydroxid. Källa: Pixabay. I det dagliga livet kan denna hydroxid övervägas på vanliga platser. Till exempel har det övre bildfartyget sin täckta yta av grön rost (inte patina). Det finns tron (OH)2, men åtföljd av många joner från havets vågor.
Kemiskt sett beror egenskaperna och användningen av detta material på tronkatjonen2+ och av hans tendens att oxidera att förvandlas till tro3+. Det är ett reducerande medel som reagerar snabbt med syre under grundläggande förhållanden. Därför bör den användas i inerta atmosfärer och syralösningar.
[TOC]
Järnhydroxidstruktur (II)
Länkar
Med tanke på bara tro (OH)2 Rent, det finns inget mer trojoner2+ och åh-.
Interaktioner mellan dem måste i teorin i teorin av jonisk natur; Varje tros tro2+ lockar två anjoner oh-, vars icke -riktade attraktioner slutar etablera en strukturell och repetitiv ordning som definierar en kristall; som i sin tur ger upphov till grönt rostdamm.
Det kan tjäna dig: zinkhydroxid (Zn (OH) 2)Problemet är att det finns en viss kovalent karaktär mellan båda jonerna, och därför kan en jonisk Fe-OH-länk inte ignoreras. Med tanke på en delvis jonisk Fe-OH-länk kan det förstås att de är grupperade i ett slags polymerskikt.
Dubbelskikt av hydroxid
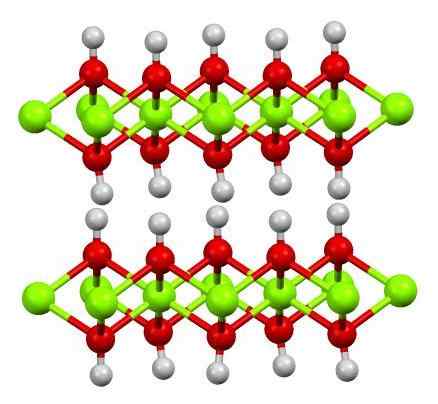
 Trosstruktur (OH) 2. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Trosstruktur (OH) 2. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Strukturen för ren järnhydroxid med en modell av sfärer och staplar visas ovan. Fe -katjonerna2+ De representeras av Chillón Green sfärer, medan oh anjoner- För de röda och vita sfärerna. Observera hur tronjoner är inriktade2+ Tack vare interaktioner (jonikalent) med OH-.
Varför är denna struktur dubbla lager av hydroxider? Bilden i sig erbjuder svaret: det finns två rader eller lager av OH- För varje tro2+; det vill säga proportion 2: 1 av tro (OH) upprätthålls2 nämndes i början.
Strukturella enheter för tro (OH)2 De är då dessa smörgåsar, där lagren av OH- De skulle komma att representera bröden; negativt laddat bröd och det misslyckas därför med att fixa en slående brun kristall.
Men å andra sidan anpassar H: s atomer också och förmörkelse med varandra. Dessa väten kommer ihåg begreppet polaritet och elektronegativitet och har en liten positiv partiell belastning, 5+; som, även om de är svaga, kan ha ett positivt område där andra anjoner eller molekyler är inrymda.
Hydrater
När tro (OH)2 Det löses upp i vattnet, dess molekyler samordnas med Metal Center of Faith2+ För att bilda en komplex ACU: [tro (h2ANTINGEN)4(ÅH)2]. Detta komplex har en oktaedral geometri för att ha sex ligander: fyra vattenmolekyler och två OH-. Men i järnhydroxid är panorama lite annorlunda.
Kan tjäna dig: lag om bevarande av materiaI hydrat, hypotetisk formel Fe (OH)2· NH2Eller vattenmolekyler finns exakt mellan de två skikten av hydroxid; Det vill säga de interagerar genom dipol-jonkrafter med vita hydrogener eller sfärer. Det är som om två Ohfeoh -matcher greps och vatten var isär för att gruppera dem: Ohfeoh (h2O) ohfeah.
Vattenmolekyler är mycket dynamiska, vilket hindrar hydratpartiklar från att förvärva betydande storlekar och följaktligen bilda en solid kolloidal eller gelé.
Grön och röd rost
I hydrater har hydroxidskikten blandat vattenmolekyler; De kan emellertid ha andra anjoner (redan nämnda), vilket orsakar ett brett utbud av gröna Herbles. De kan också "fånga" molekyler så stora som DNA eller läkemedel.
Inte bara kan trojoner vara närvarande2+, men också tro3+, produkt av intern oxidation orsakad av isär syre. Synligt skulle det observeras att grön rost (u oxid) börjar bli rödaktig när koncentrationen av tro ökar3+.
Egenskaper
 Provrör med järnhydroxid i vatten. Källa: Chemicalinterest [Public Domain]
Provrör med järnhydroxid i vatten. Källa: Chemicalinterest [Public Domain] Tro (OH) visas ovan2 fäll i ett provrör. Att vara i rikligt med vatten måste den komplexa ACU dominera över den nyligen nämnda strukturen. Observera att ytan ser ut som en orange färg, som ett resultat av oxidationen av tron2+ till tro3+ för luftens syre; Det vill säga denna hydroxid är ett reducerande medel:
Tro2+ Tro3+ + och-
Det fysiska utseendet på denna förening i dess renaste tillstånd är det av ett brunt fast ämne:
 Ren järnhydroxid. Källa: Ondřej Mangl [Public Domain]
Ren järnhydroxid. Källa: Ondřej Mangl [Public Domain] Som beroende på dess fuktighetsnivå kan presenteras som en gelégrön fast. Det är ganska olösligt i vatten (ksp= 8 · 10-16 och löslighet = 0,72 g/100 ml vid 25 ° C) och har en molmassa av 89,86 g/mol och en densitet av 3,4 g/ml.
Det kan tjäna dig: de 20 typerna av kemi och deras förnekandeIngen kokning eller fusionspunkt för denna förening rapporteras; Förmodligen på grund av det faktum att den före en värmekälla blir uttorkad och omvandlas till järnoxid, ful:
Tro (OH)2 => Ful + h2ANTINGEN
Ansökningar
Organisk kvalitativ analys
Dess reducerande kraft används för att bestämma närvaron av nitroföreningar, RNO2. Reaktionen för vilken ett positivt test erhålls representeras med följande kemiska ekvation:
Rno2 + 6fe (OH)2 + 4 timmar2O => rnh2 + 6fe (OH)3
Troen (OH)3 fälls ut som ett brunt -redizo -fast ämne, vilket certifierar närvaron av nitro -gruppen, -no2.
Selen oxoanions reducerare
Troens reducerande kraft (OH)2 Det har också använt för att minska SEO -anjoner32- (Selenito) och SEO42- (selenat) till elementärt selen,. Praktiskt taget tillåter det avlägsnande av sådana anjoner, skadligt för hälsan, i form av ett olösligt och lätt avtagbart selenfast.
Dubbelskiktsmaterial
Dess rena struktur och grön rost är en inspirationskälla för utformningen av nya material med mineralogiska egenskaper.
Det uppskattas att funktionen hos dessa tillåter transport av en specifik art mellan dess lager, på ett sådant sätt att dess befrielse kan kontrolleras eller reduceras till det aktiva stället (jord, celler, metallytan etc.).
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Järn (ii) hydroxid. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Järnhydroxid. Pubchemdatabas. CID = 10129897. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Nick Doe. (s.F.). Tester för fenoler och nitrogrupper. Kemi 211. Hämtad från: akademiker.Wellesley.Edu
- Clark Jim. (27 april 2019). Järnkemi. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Kingston teknisk programvara. (2019). Rostkemi. Korrosionsläkare. Återhämtad från: korrosionsdotorer.org
- Zingaro, Ralph A. et al. (1997). Reduktion av oxoselenjoner med järn (ii) hydroxid. Miljö internationell. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9

