Kloroxid (V) egenskaper, struktur, användning

- 3690
- 89
- Anders Svensson
han Kloroxid (V) Det är en mycket instabil inorganisk förening vars kemiska formel är cl2ANTINGEN5. Det är en av de många kloroxiderna, som kännetecknas av att vara molekylära eller till och med radikala arter.
Cl2ANTINGEN5 Han har bara hittat liv på papper och teoretiska beräkningar; Emellertid har dess existens inte uteslutits och det är troligt att vissa kan karakteriseras (av avancerade spektroskopitekniker))). Hur på grund av allmänna koncept för kemi kan förutsägas för denna oxid är att det är klorsyrans anhydrid3.
 CL2O5 -molekyl. Källa: Jynto [CC0].
CL2O5 -molekyl. Källa: Jynto [CC0]. Den hypotetiska kloroxidmolekylen (V) visas ovan (V). Observera att eftersom det är en molekyl, närvaron av CL+5; Ännu mindre när han måste ha en sådan polariserande kraft att tvinga syre och koppla kovalent.
Liksom alla instabila föreningar släpper den energi att sönderdelas i mer stabila produkter; bearbeta som i många fall är explosivt. När cl2ANTINGEN5 Det bryter friheten2 Jag2. Det är teoretiserat att i vattnet, beroende på isomeren av CL2ANTINGEN5, Flera kloroxoacider kan bildas.
[TOC]
Egenskaper
CL: s molmassa2ANTINGEN5 är 150 9030 g/mol. Från denna massa och dess hypotetiska molekyl kan det antas att om den kan isoleras skulle det förmodligen vara en oljig vätska; Naturligtvis jämför det med det fysiska utseendet på CL2ANTINGEN7.
Även om den inte kan isoleras eller karakteriseras, är denna kloroxid sur, kovalent och måste också ha ett litet dipolmoment. Dess surhet är förståelig om den kemiska ekvationen för dess hydrolys analyseras:
Kan tjäna dig: Amagat Law: Förklaring, exempel, övningarKli2ANTINGEN5 + H2Eller 2hclo3
Att vara hclo3 Klorsyran. Den omvända reaktionen skulle resultera i att syran kan dehydratiseras:
2hclo3 => Cl2ANTINGEN5 + H2ANTINGEN
Å andra sidan, när CL2ANTINGEN5 Så snart det inträffar, sönderdelas det:
2cl2ANTINGEN5 => 4Clo2 + ANTINGEN2
Det är därför en mellanhandsart istället för en oxid på rätt sätt. Dess sönderdelning måste vara så snabb (med tanke på att CL till och med är bildad2ANTINGEN5), som inte kunde detekteras med nuvarande instrumental analystekniker.
Kloroxidstruktur (V)
Molekyl
I den övre bilden visades strukturen för den hypotetiska CL -molekylen2ANTINGEN5 Med en sfärer och staplar. Röda sfärer representerar syreatomer och gröna till klor. Varje klor har en trigonal pyramidmiljö, så dess hybridisering måste vara SP3.
Således CL -molekylen2ANTINGEN5 Det kan ses som två trigonala pyramider kopplade till ett syre. Men om det noggrant observeras, leder en pyramid sina syreatomer ner, och den andra ur planet (i riktning av läsaren).
Härifrån antas det att det finns rotationer i länken eller2Cl-o-kl2, gör molekylen relativt dynamisk. Observera att formeln eller2Kloklo2 Det är ett sätt att representera CL: s struktur2ANTINGEN5.
Lewis -struktur
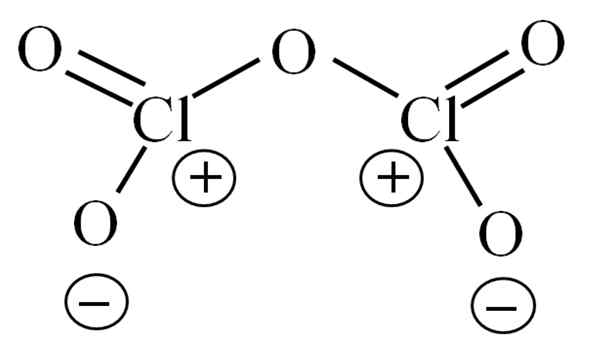 Lewis -struktur för den hypotetiska CL2O5. Källa: Gabriel Bolívar.
Lewis -struktur för den hypotetiska CL2O5. Källa: Gabriel Bolívar. Hittills har själva molekylen inte tillåtit att dechiffrera vad dess instabilitet beror på. För att belysa denna fråga används dess Lewis -struktur, representerad ovan. Observera att det felaktigt kan tro att strukturen är platt, men i den främre underavsnittet klargjordes det att det inte är så.
Kan tjäna dig: natrium azid (nan3): struktur, egenskaper, användningar, riskerVarför båda kloratomerna har positiva formella belastningar? Eftersom klor har ett par fria från elektroner, som kan verifieras när Valencia -länkteorin tillämpas (som på grund av förenkling inte kommer att göras här). Således är dess formella belastning:
CF = 7 - (4 + 2) = 1
Och vad har detta att göra med din instabilitet? Tja, klor är betydligt elektronegativt, och därför en dålig bärare av positiva formella belastningar. Detta återvänder till CL2ANTINGEN5 En extremt sur art, eftersom den måste få elektroner för att tillföra de två klorerna elektroniska efterfrågan.
Det motsatta händer med BR2ANTINGEN5 och jag2ANTINGEN5, oxider som finns under normala förhållanden. Detta beror på att både brom och jod är mindre elektronegativa än klor; Och därför stöder de den positiva formella belastningen bättre.
Isomerer och deras respektive hydrolys
Hittills har hela förklaringen fallit till en av de två isomererna i CL2ANTINGEN5: O2Kloklo2. Vilket är den andra? O3Kloklo. I denna isomer saknar klororna positiva formella belastningar och bör därför vara en mer stabil molekyl. Men både eller2Kloklo2 Som O3Cloclo bör drabbas av hydrolysreaktioner:
ANTINGEN2Cl-o-kl2 + H2O => 2nd2CL-OH (som inte är mer än HCLO3)
ANTINGEN3CL-O-CLO + H2O => o3Cl-oh (hclo4) + Ho-clo (hclo2)
Observera att upp till tre kloroxoacider kan bildas: HCLO3, Hclo4 Och hclo2
Nomenklatur
Dess namn 'kloroxid (V)' motsvarar det tilldelade enligt lager nomenklaturen. Cl2ANTINGEN5 Det kan också ha två andra namn: diklor och klyftande anhydridpentoxid, tilldelad av systematiska respektive traditionella nomenklaturer.
Kan tjäna dig: titan: historia, struktur, egenskaper, reaktioner, användningarAnsökningar
Mer än att motivera datorstudier, CL2ANTINGEN5 Det kommer att sakna användning tills det upptäcks, isoleras, karakteriseras, lagras och har visat att det inte exploderar till minsta kontakt.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Sandra Luján Quiroga och Luis José Perissinotti. (2011). Kloroxoyror och struktur hos dikloroxider. Kem. Pedagog, volym. 16.
- Kemisk formulering. (2019). Kloroxid (V). Återhämtad från: Quimica -formulering.com
- Linus Pauling. (1988). Allmän kemi. Dover Publications, Inc., New York.
- Richard C. Ropp. (2013). Encyclopedia av de alkaliska jordföreningarna. Annars.

