Hydroxider
- 1909
- 61
- Per Karlsson
Vad är hydroxider?
De Hydroxider De är oorganiska och ternära föreningar som består av interaktionen mellan en metallkation och den funktionella gruppen OH (hydroxidanjon, OH-). De flesta av dem är av en jonisk natur, även om de också kan ha kovalenta bindningar.
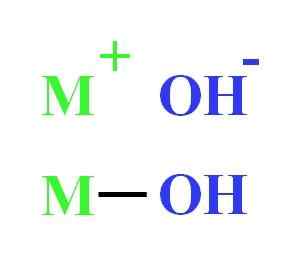
Till exempel kan en hydroxid representeras som elektrostatisk interaktion mellan katjon M+ och anjon oh-, eller som den kovalenta unionen genom M-OH-länken (lägre bild). I den första ges den joniska bindningen, medan i den andra kovalenta. Detta faktum beror väsentligen på metall eller cation+, liksom dess last och jonradio.
 Hydroxidrepresentation. Källa: Gabriel Bolívar
Hydroxidrepresentation. Källa: Gabriel Bolívar Eftersom mycket av dem kommer från metaller motsvarar det dem som metallhydroxider.
Hur bildas hydroxider?
Det finns två huvudsakliga syntetiska vägar: genom reaktion av motsvarande oxid med vattnet, eller med en stark bas i ett surt medium:
Mo + h2O => m (OH)2
Mo + h+ + Åh- => M (OH)2
Endast de vattenlösliga metalloxiderna reagerar direkt för att bilda hydroxid (första kemisk ekvation). Andra är olösliga och kräver syraarter som frigör m+, som sedan interagerar med OH- från starka baser (andra kemisk ekvation).
Dessa starka baser är emellertid NaOH, KOH och andra från Alkaline Metals (LiOH, RBOH, CSOH) metallhydroxider (CSOH). Dessa är mycket lösliga joniska föreningar i vatten, därför deras OH- De är fria att delta i kemiska reaktioner.
Å andra sidan finns det olösliga metallhydroxider och följaktligen är de mycket svaga baser. Även några av dem är sura, liksom fallet med Telluric Acid, Te (OH)6.
Hydroxid skapar en löslighetsbalans med lösningsmedlet runt det. Om det till exempel är vatten uttrycks balansen sedan på följande sätt:
M (oh)2 M2+(AC) + OH-(Ac)
Där (ac) betecknar att mediet är vattenhaltigt. När det fasta ämnet är olösligt är OH -upplöst koncentration liten eller föraktlig. Av denna anledning kan olösliga metallhydroxider inte generera lösningar så grundläggande som NaOH.
Från ovanstående kan det dras att hydroxider uppvisar mycket olika egenskaper, kopplade till den kemiska strukturen och interaktioner mellan metall och OH. Även om många är joniska, med olika kristallina strukturer, har andra istället komplexa och röriga polymerstrukturer.
Hydroxidegenskaper
Åh anjon-
Hydroxyljon är en syreatom kopplad till ett väte. Således kan detta lätt representeras som oh-. Den negativa belastningen är belägen på syre, vilket gör denna anjon till en art givare av elektroner: en bas.
Om OH- Gjort sina elektroner till ett väte, en H -molekyl bildas2ANTINGEN. Du kan också donera dina elektroner till positiva lastarter: som metallcentra m+. Således bildas ett koordinationskomplex genom M-OH-dative-länken (syre ger paret av elektroner).
Men för att detta ska hända måste syre kunna koordinera effektivt med metall, annars kommer interaktioner mellan M och OH att ha en markant jonisk karaktär (M+ Åh-).
Kan tjäna dig: Volumetrisk pipett: egenskaper, användningar, kalibrering och felEftersom hydroxyljonen är densamma i alla hydroxider, ligger skillnaden mellan dem alla i katjonen som åtföljer den.
På samma sätt, eftersom denna katjon kan komma från vilken metall som helst från den periodiska tabellen (grupper 1, 2, 14, 15, 16 eller övergångsmetallerna), varierar egenskaperna hos sådana hydroxider mycket, även om alla överväger gemensamt vissa aspekter.
Jonisk och grundläggande karaktär
Hydroxider, även om de har koordinationslänkar, har en latent jonisk karaktär. I vissa, såsom NaOH, är dess joner en del av ett kristallint nätverk som utgörs av NA -katjoner+ och oh anjoner- i proportioner 1: 1; det vill säga för varje najon+ Det finns en OH -jon- motsvarighet.
Beroende på metallbelastning kommer det att finnas mer eller mindre OH -anjoner- runt det. Till exempel för en metallkatjon m2+ Det kommer att finnas två OH -joner- Interagerar med honom: m (OH)2, Vad är skisser som ho- M2+ Åh-.
På samma sätt som det inträffar med metaller m3+ och med andra mer positiva avgifter (även om de sällan överstiger 3+).
Denna joniska karaktär är ansvarig för många av de fysiska egenskaperna, såsom fusion och kokpunkter. Dessa är höga, vilket återspeglar de elektrostatiska krafterna som fungerar inom det kristallina nätverket. När hydroxider löses eller smälts kan de också genomföra elektrisk ström på grund av deras jonernas rörlighet.
Men inte alla hydroxider har samma kristallina nätverk. De med den mest stabila kommer att vara mindre benägna att lösa upp i polära lösningsmedel som vatten. Som en allmän regel, desto mer olika joniska radioapparater+ och åh-, Mer löslig kommer att vara densamma.
Periodisk trend
Ovanstående förklarar varför lösligheten av alkaliska metallhydroxider ökar när gruppen sjunker. Således är den växande ordningen för lösligheter i vatten för dessa följande: LiOH ÅH- Det är en liten anjon, och när katjonen blir mer skrymmande försvagar det kristallina nätverket energi. Å andra sidan bildar alkalinoterösa metaller mindre lösliga hydroxider på grund av deras största positiva belastningar. Detta beror på att m2+ Det lockar mer kraft till OH- jämfört med m+. På samma sätt är dess katjoner mindre och därför är mindre ojämlika i storlek jämfört med OH-. Resultatet av detta är det experimentella beviset på att NaOH är mycket mer grundläggande än CA (OH)2. Samma resonemang kan tillämpas på andra hydroxider, antingen för de för övergångsmetaller, eller för de för P -blocket (Al, Pb, TE, etc.). Ju mindre och stora den joniska radien och den positiva belastningen på M+, Mindre kommer att vara den joniska karaktären av hydroxid, med andra ord de med mycket hög belastningstäthet. Ett exempel på detta inträffar med berylhydroxid, vara (OH)2. Han är2+ Det är en mycket liten katjon och dess tvåvärda belastning gör den elektriskt mycket tät. M hydroxider (OH)2 reagera med syror för att bilda en aquocomplex, det vill säga M+ slutar omgiven av vattenmolekyler. Det finns emellertid ett begränsat antal hydroxider som också kan reagera med baserna. Det här är de som är kända som amphoteros hydroxider. Anfoter -hydroxider reagerar både med syror och baser. Den andra situationen kan representeras med följande kemiska ekvation: M (oh)2 + Åh- => M (OH)3- Men hur man bestämmer om en hydroxid är amfoter? Genom ett enkelt laboratorieexperiment. Eftersom många metalliska hydroxider är olösliga i vatten, lägger till en stark bas till en lösning med mjoner+ upplöst till exempel till3+, Det kommer att fälla ut motsvarande hydroxid: Till3+(AC) + 3OH-(ac) => ah (oh)3(S) Men med ett överskott av OH- Hydroxid fortsätter att reagera: Al (OH)3(S) + oh- => Al (OH)4-(Ac) Som ett resultat löses det nya negativa belastningskomplexet av de omgivande vattenmolekylerna, vilket löser upp det vita aluminiumhydroxidfastill. De hydroxider som förblir oförändrade med extra -bas -tillägget uppför sig inte som syror och är därför inte amfotiska. Hydroxider kan ha kristallina strukturer som liknar de hos många salter eller oxider; några enkla, och andra mycket komplexa. Dessutom kan de där det finns en minskning av jonisk karaktär presentera metallcentra förenade med syrebroar (Hom-O-MOH). I lösning är strukturerna olika. Även om det för mycket lösliga hydroxider räcker för att betrakta dem som joner upplöst i vatten, för andra är det nödvändigt att ta hänsyn till samordningskemi. Således varje katjon m+ Det kan samordnas till ett begränsat antal arter. Ju mer skrymmande, desto större är antalet vatten eller OH -molekyler- kopplad till honom. Härifrån uppstår den berömda koordinationen Octahedron för många metaller upplöst i vatten (eller i något annat lösningsmedel): M (OH2)6+n, Att vara lika med den positiva metallbelastningen. Cr (oh)3, Till exempel verkligen en oktaedron. Som? Med tanke på föreningen som [CR (OH2)3(ÅH)3], varav tre av vattenmolekylerna ersätts av OH -anjoner-. Om alla molekyler ersattes av OH-, Då skulle det negativa belastningen och oktaedriska strukturkomplexet [CR (OH) erhållas6]3-. Lasten -3 är resultatet av de sex negativa laddningarna för OH-. Hydroxider kan betraktas som "hydratiserade oxider". Men i dem är "vatten" i direktkontakt med M+; Medan du är i fuktiga oxider Mo · NH2Eller, vattenmolekyler är en del av en extern koordinationssfär (de är inte nära metall). Dessa vattenmolekyler kan extraheras genom uppvärmning av ett hydroxidprov: M (oh)2 + Q (värme) => mo + h2ANTINGEN MO är den metalliska oxiden som bildas som ett resultat av hydroxiduttorkning. Ett exempel på denna reaktion är vad som observeras när cupric hydroxid, Cu (OH) är uttorkad2: CU (OH)2 (blå) + q => cuo (svart) + h2ANTINGEN Vad är det rätta sättet att nämna hydroxider? IUPAC höjde tre nomenklaturer för detta ändamål: det traditionella, beståndet och det systematiska. Det är korrekt att använda någon av de tre, men för vissa hydroxider kan det vara mer bekvämt eller praktiskt att nämna det på ett eller annat sätt. Den traditionella nomenklaturen består helt enkelt av att lägga till den högsta valens som metallen presenterar; och suffixet -bara det lägsta. Således, till exempel, om metall M har valenser +3 och +1, hydroxid M (OH)3 Det kommer att kallas hydroxid (metallnamn)ICO, Medan Moh Hydroxide (metallnamn)Björn. För att bestämma vad Metal Valencia i hydroxid räcker för att observera antalet efter OH inneslutet inom parentes. Således m (OH)5 Det betyder att metallen har en belastning eller valens på +5. Den huvudsakliga besväret med denna nomenklatur är dock att det kan vara komplicerat för metaller med mer än två oxidationstillstånd (som med krom och mangan). För sådana fall används hyper- och hyperprefix för att beteckna de högsta och lägsta valenserna. Således, om m istället för att endast ha valenser +3 och +1, har den också +4 och +2, så är namnen på dess största hydroxider och mindre valenser: hydroxid hyper(Metallnamn)ICO, och hydroxid hicka(Metallnamn)Björn. Av alla nomenklaturer är detta det enklaste. Här följs hydroxidens namn helt enkelt av Valencia av metallen som är låst i parentes och skriven i romerska antal. Återigen för M (OH)5, Till exempel skulle dess lager nomenklatur vara: hydroxid (metallnamn) (v). (V) Denota då (+5). Slutligen kännetecknas den systematiska nomenklaturen av att ta till multiplikatorprefix (di-, tri-, tetra-, penta-, hexa-, etc.). Dessa prefix används för att specificera både antalet metallatomer och OH -joner-. På detta sätt är M (OH)5 Det heter: Pentahidroxide av (metallnamn). När det gäller HG2(ÅH)2, Till exempel skulle det vara dihydroxid i DiMercury; En av hydroxiderna vars kemiska struktur är komplex vid första anblicken. Några exempel på hydroxider och deras motsvarande nomenklaturer är de som följer: -NaOH (natriumhydroxid) -CA (OH) 2 (kalciumhydroxid) -Tro (OH)3 (Järnhydroxid; järnhydroxid (III); eller järn trihydroxid). -V (OH)5 (Pervanathydroxid; Vanadiumhydroxid (V); eller vanadiumpennahidroxid). -SN (OH)4 (Hydroxid isñico; tennhydroxid (iv); eller tenntetrahydroxid). -BA (OH)2 (Bariumhydroxid eller bariumdihydroxid). -MN (OH)6 (Manganisk hydroxid, manganhydroxid (VI) eller mangan hexahydroxid). -Augah (argisk hydroxid, silverhydroxid eller silverhydroxid). Observera att för denna förening finns det ingen skillnad mellan lager och systematiska nomenklaturer. -PB (OH)4 (Plúmbic hydroxid, blyhydroxid (iv) eller bly tetrahydroxid). -Liop (litiumhydroxid). -CD (OH) 2 (kadmiumhydroxid). -BA (OH)2 (Bariumhydroxid). -Kromhydroxid.Anoterism
Strukturer
Uttorkningsreaktion
Hydroxid nomenklatur
Traditionell
Stock
Systematisk
Exempel på hydroxider
 Natriumhydroxidutseende
Natriumhydroxidutseende  Utseende av fast tillståndskalciumhydroxid
Utseende av fast tillståndskalciumhydroxid Referenser

