Hydroniojon
- 2194
- 94
- Lars Eriksson
Vad är hydroniumjonen?
han Hydroniojon Det är en slags positiv belastning som är resultatet av protoneringen av en vattenmolekyl och vars kemiska formel är h3ANTINGEN+. Den består av de enklaste oxonierna: joner där syre bär en positiv formell belastning och har tre kovalenta bindningar.
H3ANTINGEN+ Det är en av de enklaste men nyfikna katjonerna som finns. I vatten under normala förhållanden har den en koncentration av 1 · 10-7 M, produkten av självtiveringsbalansen. Emellertid ökar dess koncentration exponentiellt när den är stark3ANTINGEN+ De löses upp i vattnet och försurar det.
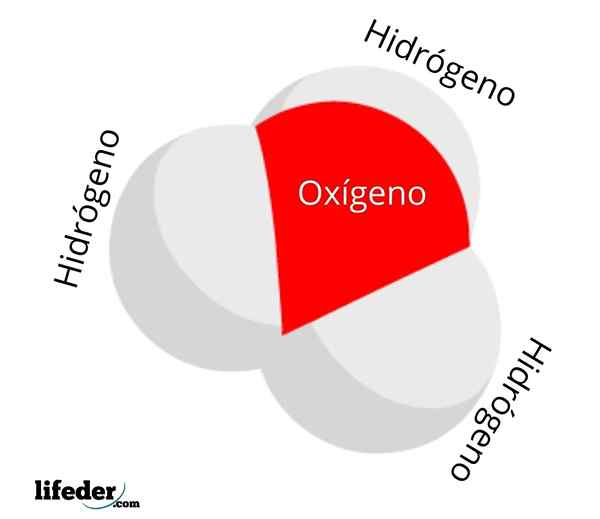
 Hydronjonmolekyl
Hydronjonmolekyl Koncentrationen eller aktiviteten hos H3ANTINGEN+ I vattnet tjänar det till att mäta surheten hos de vattenhaltiga lösningarna: pH. Ju fler hjoner3ANTINGEN+ Hö, mindre positivt kommer att vara pH, och mer syra kommer att vara lösningen i fråga. Denna surhet ligger å andra sidan i vätejonen, h+, som ofta förväxlas med jon h3ANTINGEN+.
 Jon- eller hydroniokatjonformel
Jon- eller hydroniokatjonformel H+ och dess fantastiska förmåga att överföra mellan vätebroarna i vattenmolekylerna tillåter H3ANTINGEN+ associera i mer komplexa katjonformationer; som Eigen's katjon, h9ANTINGEN4+, och Zundels katjon, h5ANTINGEN2+, och många andra.
Hydronionjonstruktur
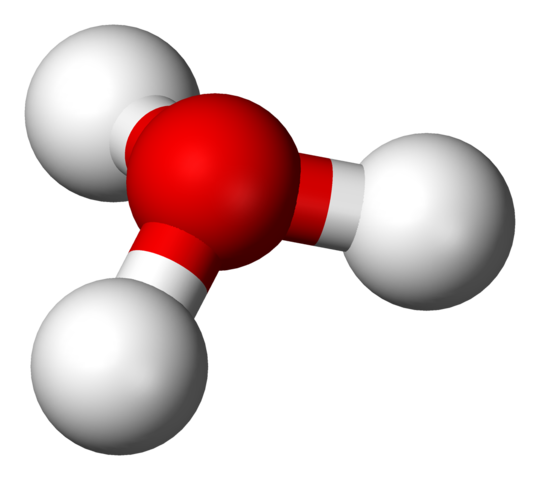 H3O+ struktur med en sfärer och staplarmodell
H3O+ struktur med en sfärer och staplarmodell I den första bilden kunde du se den strukturella formeln för hydrriumjonen. Nu ser vi dess representation med en sfärer och staplarmodell. I båda höjdpunkterna är den trigonala pyramidgeometri, vars länkvinklar (O-H) är 113º; Lite avledd från 119º för tetrahedronen.
Även om syre har en positiv partiell belastning, betyder detta inte att det negativa området är runt väteatomer. Tvärtom. Syre i H3ANTINGEN+ Det är ännu mer elektronegativ produkt av dess elektroniska brist; Så all den negativa densiteten visualiseras på en elektrostatisk potentiell karta:
Kan tjäna dig: kaliumsulfat (K2SO4): Struktur, egenskaper, användningar, syntes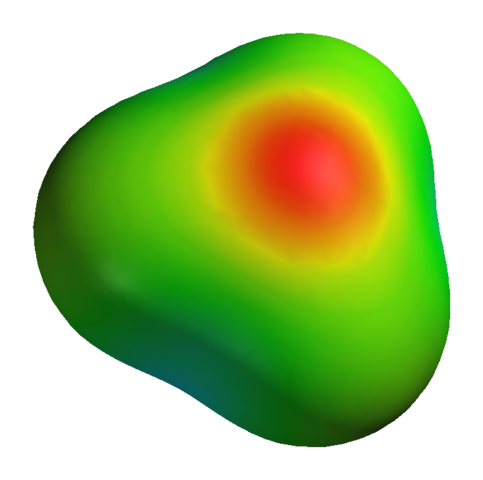 Elektrostatisk potentiell karta för H3O+
Elektrostatisk potentiell karta för H3O+ För att inte tala om att syre har ett par fria elektroner, vilket förstärker ännu mer negativ densitet.
En konsekvens av allt ovan är att H -hydrogener3ANTINGEN+ De förlorar elektronisk densitet, eftersom syre lockar den mot sig själv. Därför h3ANTINGEN+ Du kan etablera mycket starka vätekällor med en angränsande vattenmolekyl: h2ANTINGEN+-H-oh2.
Denna interaktion är nyckeln bakom den fantastiska joniska rörligheten hos H+ och varför h3ANTINGEN+ Det kan associeras med många vattenmolekyler samtidigt.
Aciditet
Hydroniojon är en mycket stark syra. I själva verket är det den starkaste syran som kan existera i vattenlösning. Därför att? Eftersom alla andra syra som är starkare än honom kommer att protonera en vattenmolekyl för att komma från H3ANTINGEN+:
Ha + h2O → a- + H3ANTINGEN+
H3ANTINGEN+ Det kan hålla sig stabilt när det inte finns några andra baser i miljön som är starkare än vatten. Varje syra har uppfyllt detta kommer att klassificeras som en stark syra. Under tiden, om syran är svagare än h3ANTINGEN+, Då kommer en del av HA inte helt dissocierad och vi kommer att prata om en svag syra:
Ha + h2Eller ⇌ a- + H3ANTINGEN+
Därför, sedan h3ANTINGEN+ Det är den starkaste syran som finns i vattnet, surheten kommer att bero på koncentrationen av H3ANTINGEN+. Detta är grunden att på enkla termer definiera surheten av en vattenhaltig lösning uttryckt som pH:
pH = -log [h3ANTINGEN+]
H+ mot. H3ANTINGEN+
Vätejon och hydronium är inte desamma. H+ Det är mycket surare än h3ANTINGEN+, Tja, det består av en proton ingenting mer, som kommer att leta efter en molekyl för att få elektroner på alla sätt. När h+ få en vattenmolekylformulär h3ANTINGEN+:
Det kan tjäna dig: Cupric Oxide (CUO)H+ + H2O → h3ANTINGEN+
Det är därför h3ANTINGEN+ kan representeras som h+(Ac), indikerar att det är en h+ I vattenhaltigt medium.
Kraften i en syra mäts i sin förmåga att donera, enligt definitionen av Brönsted-Lowry, H-joner+. Hur mycket starkare det är, desto mer kommer det att donera+, Ingen h3ANTINGEN+. De starkaste syrorna som någonsin syntetiserats (supercider) är de där h+ Han är "naken"; det vill säga utan något hinder för att hoppa mot molekylen som kommer att protonera.
Praxis att representera h3ANTINGEN+ Som h+(AC) Det är så vanligt att det många gånger pratar om båda som om de var desamma, utan att det negativt påverkar tolkningen av lösningarnas kemi.
Solvation
H3ANTINGEN+ Det kan bilda mycket starka vätebroar med en angränsande vattenmolekyl. På så sätt har vi katjonen av Zundel, h5ANTINGEN2+:
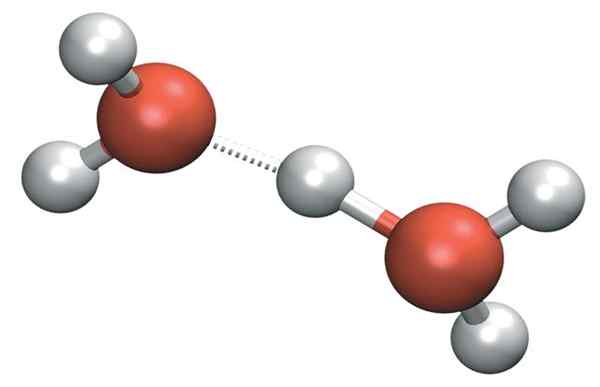 Zundelkation
Zundelkation Men den positiva belastningen förblir inte bara på en enda sida av katjonen: detta kan överföras till den andra vattenmolekylen som jon h+:
H2O- h-+Åh2 → H2ANTINGEN+-H- OH2
Därför fördelas den positiva belastningen mellan båda syreatomerna för de två vattenmolekylerna.
När det gäller egenskationen, h9ANTINGEN4+, en h3ANTINGEN+ Forma vätebroar med tre vattenmolekyler och fördelar bland dem den positiva belastningen tack vare en "hopp" h+. Dessa hopp är så snabba att de förklarar den stora joniska rörligheten hos h+ I vatten, med h3ANTINGEN+ som ett fordon och vattenmolekyler som en motorväg.
H5ANTINGEN2+ och h9ANTINGEN4+ De är inte de enda katjoniska föreningarna som h3ANTINGEN+ kan komma från vatten. Vissa molekylära dynamikberäkningar visar förekomsten av ett H -kluster3ANTINGEN+(H2ANTINGEN)tjugo: 20 timmars molekyler2Eller interagera med en H -katjon3ANTINGEN+ och fördelar bland dem den positiva belastningen.
Kan tjäna dig: Neodymium: Struktur, egenskaper, användningarDärför h3ANTINGEN+ och h+ De bygger en nyfiken relation med vattenmolekyler, utöver surhet.
Du går ut
Precis som organiska oxyrum finns, är det inget undantag med oxy härrörande från vattenprotonation. Dess allmänna formel är [h3ANTINGEN+] [X-], Där x- Det är någon anjon som kommer från upplösningen av en mycket stark syra.
Dessa salter får ibland namnet "monohydratsyror", eftersom formeln [h3ANTINGEN+] [X-] eller h3ANTINGEN+· X- Det kan också skrivas som hx · h2ANTINGEN. Således kan det finnas dihydratsyror, Hx · 2h2Eller, trihydrater, hx · 3h2Eller, etc.
Till exempel kan HCl kristallisera som HCl · H2O h3ANTINGEN+· Cl-. Vi har också andra hydroniumsalter som h3ANTINGEN+· Clo4- eller hclo4· H2Eller, och hbr · 4h2O h3ANTINGEN+· Br-· 3 timmar2ANTINGEN.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Inorgán kemiICA. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Hydronium. Hämtad från: i.Wikipedia.org
- Avneet Kahlon & Stephen Lower. (15 augusti 2020). Hydroniumjonen. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (25 augusti 2020). Hydroniumjondefinition. Återhämtat sig från: tankco.com
- Redaktörerna för Enyclopaedia Britannica. (2020). Vätejon. Återhämtat sig från: Britannica.com

