Isóbaros
- 3319
- 1067
- Karl Johansson
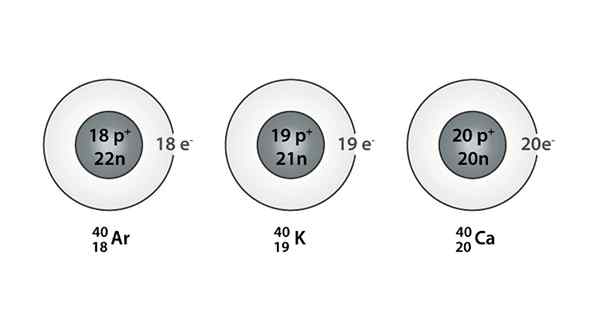
 Exempel på isóbaro; Argon, kalium och kalcium, som har atomer av samma massa (40)
Exempel på isóbaro; Argon, kalium och kalcium, som har atomer av samma massa (40) Vad är isoparosna?
De Isóbaros Det är de atomiska arterna som har samma massa men som kommer från olika kemiska element. Som en följd av detta kan det sägas att de utgörs av olika antal protoner och neutroner.
Både protoner och neutroner är i kärnan i sina atomer, men nettomängden av neutroner och protoner som finns i varje kärna förblir densamma. Med andra ord, en isóbara -art har sitt ursprung när ett par atomkärnor visar samma nettoantal neutroner och protoner för varje art.
Antalet neutroner och protoner som utgör att nettobeloppet är annorlunda. Ett sätt att märka det är att observera massantalet (som placeras på den övre vänstra sidan av symbolen för det kemiska elementet som representeras), eftersom detta nummer i isopierna är detsamma är detsamma är detsamma.
Etymologin för isóbaro -termen kommer från grekiska ord Isos (vilket betyder "samma") och Baros (vilket betyder "vikt"), som hänvisar till jämställdhet av vikter mellan båda kärnarten.
Isoparos egenskaper
- Isoparos håller vissa likheter med andra arter vars kärnor presenterar sammanfall, såsom de isotona, som har samma mängd neutroner men med olika massa och atomantal, till exempel kamrater 13C och och 14Nej 36S och 37Kli.
- Termen "nukleid" är valören som har myntats till var och en av kärnuppsättningarna (strukturer bildade av neutroner och protoner) som kan bildas. Så att nukleiderna möjligen skiljer sig genom deras antal neutroner eller protoner, eller till och med för den mängd energi som strukturen för dess konglomeration har.
Kan tjäna dig: Liquefaction: Concept, Gases, Soils and Seismic, Seminal- På samma sätt finns det en barnkärna uppstår efter att ß och denna process i sin tur är en isopar av fars kärna, eftersom antalet nukleoner som finns i kärnan förblir oförändrad, till skillnad från vad som händer med hjälp av upplösning a.
- Det är viktigt att komma ihåg att de olika isóbarosna har olika atomantal, vilket bekräftar att de är olika kemiska element.
Representation
För att beteckna de olika nukleiderna används en specifik notation, som kan representeras på två sätt: en består av att placera namnet på det kemiska elementet följt av deras massnummer, som är förenade med ett skript. Till exempel: kväve-14, vars kärna består av sju neutroner och sju protoner.
Det andra sättet att representera dessa arter är att placera symbolen för det kemiska elementet, föregått av en numerisk superstice som indikerar det massnummer som atomen i fråga har, liksom ett numeriskt underskrift som anger dess atomnummer på följande sätt :
ZTILLX
I detta uttryck x representerar det det kemiska elementet i atomen i fråga, A är massantalet (resultatet av tillsatsen mellan mängden neutroner och protoner) och z representerar atomantalet (lika med mängden protoner i kärnan i atomen).
När dessa nukleider representeras utelämnas vanligtvis atomantalet för atomen (Z) eftersom det inte ger relevant ytterligare data, så de representeras ofta som TILLX.
Ett sätt att visa denna notation är att ta föregående exempel (kväve-14), som också betecknas som 14N. Detta är notationen som används för isoboos.
Kan tjäna dig: materiens omfattande egenskaperExempel på isóbaros
Användningen av uttrycket "isóbaros" för arter som kallas nukleider som har samma antal nukleoner (lika massantal) föreslogs i slutet av 1910 -talet av kemisten i det brittiska ursprunget Alfred Walter Stewart.
I denna ordningsordning kan ett exempel på isoboo observeras vid arter 14C och och 14N: Massanalet är lika med 14, detta innebär att antalet protoner och neutroner i båda arterna är olika.
Faktum är att denna kolatom har ett atomnummer lika med 6, så i sin struktur finns det 6 protoner, och i sin tur har den 8 neutroner i sin kärna. Då är ditt massnummer 14 (6+8 = 14).
För sin del har kväveatomen ett atomnummer lika med 7, så det består av 7 protoner, men den har 7 neutroner i sin kärna. Ditt massnummer är också 14 (7+7 = 14).
Du kan också hitta en serie där alla atomer har ett massnummer lika med 40; Detta är fallet med isóbaros: 40Växelström, 40K, 40Ar, 40Cl och 40S.
Skillnader mellan isoto och isotoper
Nukleiderna beskriver de olika typerna av atomkärnor som finns, beroende på mängden protoner och neutroner de har.
Likaså, mellan dessa typer av nukleider är isotropos och isotoperna, som kommer att differentieras nedan.
När det gäller isóbaros, som nämnts tidigare, har de samma antal nukleoner -det vill säga samma massantal -där antalet protoner genom vilka en art är högre än den andra håller med antalet neutroner som finns i underskott, så summan är densamma. Men ditt atomnummer är annorlunda.
Det kan tjäna dig: kristalloidlösningar: Komposition, typer och exempelI detta avseende kommer de isopiska arterna från olika kemiska element, så de är belägna i olika utrymmen i det periodiska bordet och har olika egenskaper och specifika egenskaper.
Å andra sidan, i fallet med isotoper händer det motsatta, eftersom de har samma atomantal men olika massmassa; Det vill säga de har samma antal protoner men olika antal neutroner i deras atomkärnor.
Dessutom är isotoperna atomarter som tillhör samma element, så de är belägna i samma utrymme i periodiska tabellen och har liknande egenskaper och egenskaper.

