Charles lagformler och enheter, experiment, övningar

- 2315
- 702
- Per Eriksson
De Charles Law eller av Guy-Lussac är en som tillåter uttalandet om en av det gasformiga tillståndets egenskaper: Volymen som en gas upptar är direkt proportionell mot temperaturen vid konstant tryck.
Denna proportionalitet är linjär för alla temperaturer om gasen i fråga är idealisk; Royal Gases, å andra sidan, avviker från den linjära trenden vid temperaturer nära deras kondensationspunkt. Detta har emellertid inte begränsat användningen av denna lag för oändliga tillämpningar där gaser deltar.
 Kinesiska lyktor eller önskemål. Källa: Pxhere.
Kinesiska lyktor eller önskemål. Källa: Pxhere. En av de par excellensen i Charles lag är närvaro i aerodynamiska ballonger. Andra enklare ballonger, som önskningar, även kallad kinesisk lampa.
Varför konstant tryck? För om trycket ökade skulle det betyda att behållaren där gasen är belägen är tätt stängd; Och med detta skulle kollisionerna eller effekterna av gasformiga partiklar mot de inre väggarna i nämnda container (Boyle-Maleotte-lagen) öka kollisionerna eller effekterna av de inre partiklarna (Boyle-Maleotte Law).
Därför skulle det inte ske någon förändring i den volym som upptar av gas, och Charles lag skulle inte vara rigoritet. I motsats till en hermetisk behållare representerar vävnaden i ballongerna i önskningar en mobil barriär, som kan expandera eller sammandras beroende på det tryck som utövas av gasen inuti.
Men när ballongvävnaden expanderar förblir det inre trycket på gasen konstant eftersom det ökar området över vilket dess partiklar kolliderar. Ju högre gastemperatur, desto större är partiklarnas kinetiska energi och därför antalet kollisioner.
Och när världen expanderar igen förblir kollisioner mot dess inre väggar konstant (idealiskt).
Så ju varmare gasen är, desto större är utvidgningen av världen och desto mer kommer den att stiga. Resultatet: rödaktiga (även om farliga) lampor upphängda på himlen under nätter december.
[TOC]
Vad är Charles lag?
Påstående
Den så kallade Charles Law eller Gay-Lussacs lag förklarar beroendet som finns mellan den volym som har ockuperats av en gas och värdet på dess absoluta temperatur eller Kelvin-temperatur.
Lagen kan uttalas enligt följande: Om trycket förblir konstant, uppfylls det att ”för en given massa av en gas ökar den volymen med 1/273 gånger ungefär sin volym till 0 ºC, för varje grad Centigrade (1 ºC ) som ökar temperaturen ".
Jobb
Forskningsarbeten som tillät etablering av lagen inleddes på 1780-talet av Jacques Alexander Cesar Charles (1746-1823). Charles publicerade emellertid inte resultaten från hans utredningar.
Därefter lyckades John Dalton 1801 experimentellt bestämma att alla gaser och ångor, studerade av honom, expanderade mellan två bestämda temperaturer i samma volym. Dessa resultat bekräftades av Gay-Lussac år 1802.
Forskningsarbeten från Charles, Dalton och Gay-Lussac, fick konstatera att volymen som ockuperas av en gas och dess absoluta temperatur är direkt proportionella. Därför finns det ett linjärt samband mellan temperaturen och en gasvolym.
Det kan tjäna dig: metoder för separering av heterogena blandningarGraf
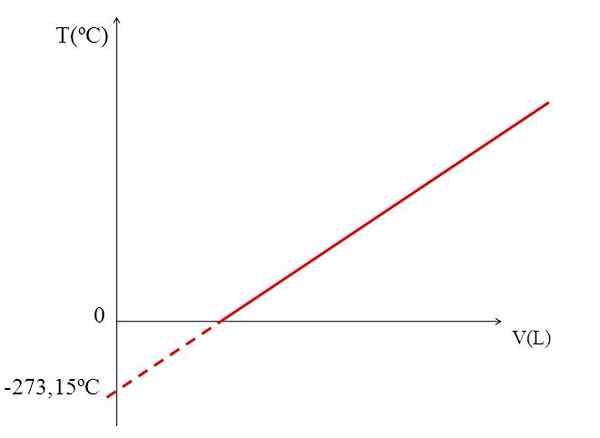 T vs V -graf för en idealisk gas. Källa: Gabriel Bolívar.
T vs V -graf för en idealisk gas. Källa: Gabriel Bolívar. Förverkligandet av en graf (övre bild) av en gasvolym mot temperaturen ger en rak linje. Korsningen mellan linjen med X -axeln, vid temperaturen 0 ºC, gör det möjligt att erhålla volymen gas vid 0 ºC.
På samma sätt skulle skärningspunkten mellan linjen med X -axeln ge information om den temperatur som den volym som upptar av gasen skulle vara noll "0". Dalton uppskattade detta värde vid -266 ºC, nära det värde som Kelvin föreslog för absolut (0) absolut.
Kelvin föreslog en temperaturskala vars noll skulle vara temperaturen vid vilken en perfekt gas skulle ha en volym av noll. Men vid dessa låga temperaturer är gaserna flytande.
Det är därför vi inte kan prata om volymer av gaser som sådana och konstatera att värdet för absolut noll ska vara -273,15 ºC.
Formler och mätenheter
Formler
Charles lag i sin moderna version indikerar att volymen och temperaturen på en gas är direkt proportionell.
Så:
V / t = k
V = gasvolym. T = kelvin temperatur (k). K = proportionalitetskonstant.
För en volym v1 och en temperatur t1
k = v1 / T1
Också för en volym v2 och en temperatur t2
k = v2 / T2
Sedan matchar du de två ekvationerna för K
V1 / T1 = V2 / T2
Denna formel kan skrivas enligt följande:
V1 · T2 = V2 · T1
Clearing v2, Formeln erhålls:
V2 = V1 · T2 / T1
Enheter
Gasvolymen kan uttryckas i liter eller i någon av dess härledda enheter. På samma sätt kan volymen uttryckas på kubikmeter eller i någon härledd enhet. Temperaturen måste uttryckas i absolut temperatur eller kelvin temperatur.
Så om temperaturen för en gas uttrycks i Celsius eller Celsius skala, för att utföra en beräkning med dem, bör mängden 273,15 ºC läggas till temperaturer för att ta dem till absoluta temperaturer eller Kelvin.
Om temperaturen uttrycks i grader Farenheit, bör den läggas till dessa temperaturer 459,67 ºR för att få dem till absoluta temperaturer på Rankine -skalan.
En annan känd formel av Charles lag, och direkt relaterad till dess uttalande, är följande:
Vt = Vantingen (1 + t/273)
Där vt Det är den volym som upptar av en gas vid en viss temperatur, uttryckt i liter, cm3, etc.; och vantingen Det är den volym som en gas ockuperar vid 0 ºC. För sin del är t temperaturen vid vilken volymmätningen görs, uttryckt i Celsius (ºC) grader (ºC).
Och slutligen representerar 273 det absoluta nollvärdet på Kelvin -temperaturskalan.
Experiment för att demonstrera lagen
Montering
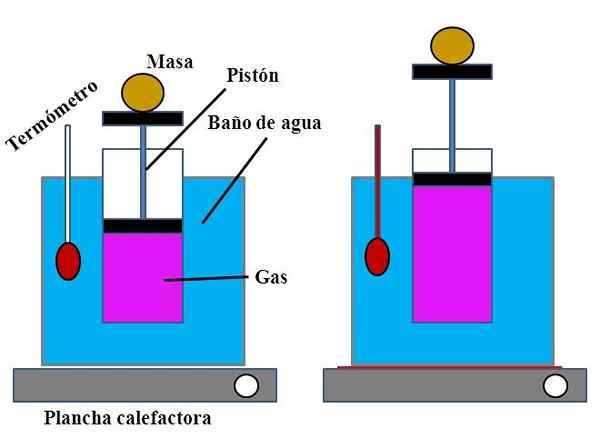 Montering av experimentet för att demonstrera Charles lag. Källa: Gabriel Bolívar.
Montering av experimentet för att demonstrera Charles lag. Källa: Gabriel Bolívar. I en vattenbehållare, som uppfyllde funktionen av ett vattenbad, placerades en öppen cylinder av dess övre del, med en kolv som justerades till cylinderns innervägg (överlägsen bild).
Denna kolv (bildad av kolven och de två svarta baserna) kunde flytta till den övre eller nedre delen av cylindern beroende på volymen av gas som den innehöll.
Vattenbadet kan värmas genom att använda en tändare eller värmeanläggning, som tillförde värmen som krävs för att öka badrumstemperaturen och därför är cylinderns temperatur utrustad med en kolv.
Kan tjäna dig: Kalciumhydroxid (CA (OH) 2): Struktur, egenskaper, erhållning, användningPå kolven placerades en viss massa för att säkerställa att experimentet genomfördes vid konstant tryck. Badrummet och cylindertemperaturen mättes med hjälp av en termometer placerad i vattenbadet.
Även om cylindern förmodligen inte hade en examen för att visualisera luftvolymen, kan detta uppskattas genom att mäta höjden som massan placerad på kolven och ytan på cylinderbasen.
Utveckling
Volymen på en cylinder erhålls genom att multiplicera ytan på sin höjd. Ytan på cylinderbasen kan erhållas genom att tillämpa formeln: s = pi x r2.
Medan höjden erhålls genom att mäta avståndet från cylinderns bas, till kolven som degen vilar.
När badrumstemperaturen ökade med värme som producerats av tändaren observerades att kolven steg inuti cylindern. Sedan läser de temperaturen i vattenbadet i termometern, vilket motsvarade cylinderns inre.
De mäter också höjden på degen på kolven och kan uppskatta luftvolymen som motsvarade den uppmätta temperaturen. På detta sätt gjorde de flera temperaturmätningar och uppskattningar av luftvolymen motsvarande var och en av temperaturerna.
Detta kan äntligen konstatera att volymen som en gas ockuperar är direkt proportionell mot dess temperatur. Denna slutsats tillät att ange den så kallade Charles -lagen.
Globo med is på vintern
Förutom det föregående experimentet finns det en enklare och mer kvalitativ: den av ballongen med is på vintern.
Om en ballong på vintern var full av helium i ett rum med uppvärmning placerades, skulle världen ha en viss volym; Men om det sedan flyttades till utsidan av huset med låg temperatur, skulle det observeras att heliumballongen krymper, vilket minskar sin volym enligt Charles lag.
Löst övningar
Övning 1
Du har en gas som upptar en volym av 750 cm3 vid 25 ºC: Vad kommer att vara volymen som denna gas upptar vid 37 ºC om det ständiga trycket upprätthålls?
Det är nödvändigt att först transformera temperaturenheterna till Kelvin:
T1 I grader kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 I grader kelvin = 37 ºC + 273,15 ºC = 310,15 K
Eftersom det är känt v1 och de andra variablerna, det rensar V2 Och det beräknas med följande ekvation:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Övning 2
Vad skulle vara temperaturen i grader Celsius till vilken 3 liter en gas ska värmas till 32 ° C, så att volymen expanderar till 3,2 liter?
Återigen förvandlas Celsius -graderna i Kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Och som i föregående övning rensas T2 Istället för v2, och beräknar sedan:
T2 = V2 · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Men uttalandet ber om grader Celsius, så enheten för t ändras2:
T2 I grader Celsius = 325, 49 º C (K) - 273,15 ºC (K)
Kan tjäna dig: pascal spruta= 52,34 ºC
Övning 3
Om en gas vid 0 ºC upptar en volym på 50 cm3, Vilken volym kommer den att ockupera vid 45 ºC?
Använda den ursprungliga formeln i Charles's Law:
Vt = Vantingen (1 + t /273)
Fortsätt att beräkna vt direkt när du bortskaffar alla variabler:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Å andra sidan, om problemet löses med hjälp av strategin för exempel 1 och 2, kommer vi att ha:
V2 = V1 · (T2 / T1)
= 318 K · (50 cm3 / 273 k)
= 58,24 cm3
Resultatet, som tillämpar de två förfarandena, är detsamma eftersom de i slutändan baseras på samma princip i Charles Law.
Ansökningar
Önskangaller
Ballongerna av önskemål (som redan nämnts i inledningen) är utrustade med ett textilmaterial som impregneras med en brännbar vätska.
När brand avfyrar detta material finns det en ökning av lufttemperaturen i världen, vilket orsakar en ökning av gasvolymen enligt Charles lag.
Genom att öka luftvolymen i världen minskar därför luftens densitet i den, vilket görs mindre än tätheten av den omgivande luften, och det är därför världen stiger upp.
Pop-up-termometrar eller kalkoner
Som anges med namnet används de under matlagning av kalkoner. Termometern har en behållare full av stängd luft med lock och kalibreras på ett sådant sätt att när man når den optimala tillagningstemperaturen lyfts locket genom att avge ett ljud.
Termometern placeras i kalkon, och när temperaturen ökar inuti ugnen expanderar luften inuti termometern, vilket ökar volymen. Så när luftvolymen når ett visst värde gör det termometerlyftet.
Återhämtning av formen av ping-pongbollar
Ping-pongbollar beroende på kraven för deras användning är av lätt och deras plastväggar är lite tjocka. Detta gör att de påverkas av racketarna drabbas av deformationer.
Genom att placera de deformerade bollarna i varmt vatten värms luften inuti och dess expansion inträffar, vilket leder till en ökning av luftvolymen. Detta orsakar också en sträcka av ping-pong-bollarna, som möjliggör återhämtning av sin ursprungliga form.
Utarbetande av PAES
Jäst är införlivade i vetemjöl som används för att tillverka bröd och har förmågan att producera koldioxidgas.
Genom att öka temperaturen på brödet under tillagningen ökar koldioxidvolymen. Det är på grund av detta att en utvidgning av brödet inträffar tills den önskade volymen har uppnåtts.
Referenser
- Clark j. (2013). Oter Gas Laws - Boyle's Law and Charles 'Law. Återhämtat sig från: Chemguide.co.Storbritannien
- Staroscik Andrew. (2018). Charles lag. Hämtad från: Scienteprimer.com
- Wikipedia. (2019). Charles Law. Hämtad från: i.Wikipedia.org
- Helmestine, Todd. (27 december 2018). Vad är formeln för Charles lag? Återhämtat sig från: tankco.com
- Prof. N. Lejon. (s.F.). Elementära gaslagar: Charles Law. C 101 klassanteckningar. Återhämtat sig från: iun.Edu
- Briceño gabriela. (2018). Charles Law. Återhämtat sig från: euston96.com
- Morris, J. G. (1974). Fysikalisk för biologer. (2ger utgåva). Redaktionell reverté, s.TILL.
- « Fjorton poäng med Wilson -bakgrund och hur det påverkade Tyskland
- Tillämpningar av begreppen energi, kraft, styrka, arbete »

