Smozymegenskaper, struktur, funktioner
- 2437
- 122
- Prof. Erik Johansson
De Smozymer De är hydrolytiska enzymer som är allmänt fördelade i naturen som kan hydrolysera de glukosidiska bindningarna av peptidoglykan i bakterieväggen. De finns i växter och djur och fungerar som en försvarsmekanism mot bakterieinfektioner.
Upptäckten av dessa enzymer går tillbaka till 1922, när Alexander Fleming insåg att det fanns ett protein som hade den katalytiska kapaciteten hos Lisar -bakterier i vissa vävnader och mänskliga sekretioner.
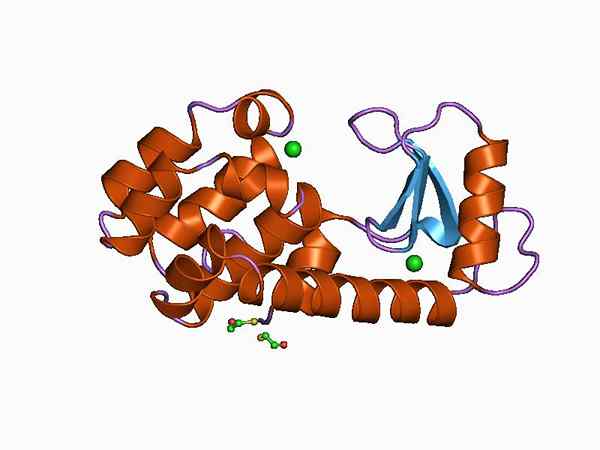
 Grafisk representation av strukturen för smidigheten (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Grafisk representation av strukturen för smidigheten (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Tack vare det enkla att få och dess lilla storlek, lysozy. Det används för närvarande som ett modellsystem inom kemi, enzym, kristallografi och proteinmolekylärbiologi.
Smozyme är ett "bakteriolitiskt" enzym som specialiserat sig på hydrolys av ß -1,4 glukosidbindningsgram -positiva bakterier.
Den har olika funktioner, både matsmältning och immunologiska, i alla organismer där det uttrycks och används som en bioteknologisk resurs för flera ändamål.
[TOC]
Egenskaper
Smidigheten uttrycks av de viktigaste grupperna av levande organismer på planeten, men är särskilt rik i djur och det är från dessa som har renats och studerats mer.
Hos människor är lyszymet i höga koncentrationer i olika vätskor och vävnader som lever, brosk, saliv, slem och tårar. Det uttrycks av hematopoietiska celler och finns också i granulocyter, monocyter och makrofager, liksom i andra föregångsceller i benmärgen.
Kan tjäna dig: grov endoplasmisk retikulumSmozymer av växt ursprung hydrolysubstrat som liknar de som används av andra nära besläktade enzymer som kallas kitinaser, av detta skäl kan de också hydrolysera bindningar i kitin, även om de är mindre effektivitet.
Typer av jämnhet hos djur och deras egenskaper
Minst tre typer av jämnhet har beskrivits i djurriket:
-Den släta C ("C" av "conventionell "eller"cHicken ", Vad betyder kyckling på engelska)
-Smozyme G ("G" av "gOskjuten”, Vilket betyder gås på engelska) och
-Den släta typen I ("i" av "Yonvertebrater ”)
De tre klasserna av smoothies skiljer sig från varandra med avseende på deras aminosyrasekvenser, deras biokemiska egenskaper och deras enzymatiska egenskaper.
SLEANS TYP C
Dessa smidighet betraktas som de "modellen" -enzymerna i denna familj, eftersom de har fungerat som en modell för struktur och funktionsstudier. De är kända som typ "C" på engelska "Kyckling"Eftersom de först isolerades från kycklingägg.
I denna klass är den smidighet som produceras av de flesta ryggradsdjur, särskilt av fåglar och däggdjur. Det inkluderar också enzymer som finns i vissa leddjur som Lepidoptera, Diptera, några araknider och kräftdjur.
De är små enzymer eftersom de har en molekylvikt som inte överstiger 15 kDa. De är grundläggande proteiner med höga isoelektriska punkter.
SLEANS TYP G
Den första jämnheten av denna typ identifierades i ägget klart.
I vissa fall är Gy -typen jämna överflöd än typ C -slätningar i äggviterna hos vissa fåglar, medan det motsatta inträffar är de släta CS av typ C mer riklig.
Kan tjäna dig: LenticelaDessa smidighet finns också i bivalve blötdjur och vissa tunicates. De är lite större proteiner än de av typ C, men deras molekylvikt överstiger vanligtvis inte 25 kDa.
Slians Type I
Dessa jämnhet finns främst hos ryggradslösa djur. Dess närvaro har bestämts i anélidos, echinoderms, kräftdjur, insekter, blötdjur och nematoder och är frånvarande hos däggdjur och andra ryggradsdjur.
De har surare isoelektriska punkter än de av typ C och typ G -proteiner.
Strukturera
De tre typerna av djurenzymer som beskrivs i föregående avsnitt har ganska liknande tre dimensionella strukturer.
Människans smidighet är en smidig typ C och var den första av dessa enzymer som studerades och strukturellt karakteriserade. Det är ett litet protein av 130 aminosyravfall och kodas av en gen belägen på kromosom 12, som har 4 exoner och 3 introner.
Dess struktur är uppdelad i två domäner: en känd som domän a Och en annan som p -domän. A -domänen består av fyra alfa -hallar och ß -domänen som bildas av ett antiparelala ß -ark och en stor slinga.
Det katalytiska platsen för enzymet är i klyftan som bildas mellan båda domänerna och för korsningen med substratet har slöseri med glutaminsyra och asparaginsyra. Dessutom har den minst sex "subsitios" kända som A, B, C, D, E och F, som kan gå med sex på varandra följande slöseri med sockerarter.
Funktioner
Smidigheten har inte bara fysiologiska funktioner i skyddet och striden mot bakteriella infektioner i organismerna som uttrycker den, utan, som har kommenterats har det varit mycket användbart som en enzymmodell från den kemiska, enzymatiska och strukturella synvinkeln.
Kan tjäna dig: epitelceller skivepåI den nuvarande branschen erkänns den som en kraftfull baktericid och används för att bevara mat och droger.
Tack vare reaktionen som dessa enzymer katalyserar kan de verka på olika bakteriepopulationer och förändra stabiliteten hos deras väggar, vilket därefter översätter till celllys.
I samband med andra liknande enzymer kan smidighet verka på både Gram -positiva bakterier och på Gram -negativa bakterier, så att de kan betraktas som delar av det antibakteriella "immun" -systemet av olika typer av organismer.
I de vita blodkropparna som finns i blodet från däggdjur har dessa enzymer viktiga funktioner i nedbrytningen av invaderande mikroorganismer, så de är viktiga för immunsystemet hos människor och andra däggdjur.
Smozymer i växter uppfyller i huvudsak samma funktioner som hos djuren som uttrycker dem, eftersom de är som en första försvarslinje mot bakteriepatogener.
Referenser
- Callewaert, l., & Michels, W. (2010). Lysozymer i djurriket. J. Biosci., 35(1), 127-160.
- Merlini, g., & Bellotti, V. (2005). Lysozym: En paradigmatisk molekyl för forskning om proteinstruktur, funktion och felfoldning. Klinikkemisk lag, 357, 168-172.
- Se. (1977). Lysozyme: En kort recension. Forskarutbildning, 53, 257-259.
- Sahoo, n. R., Kumar, s., Bhusan, f., Bhattacharya, t. K., Dayal, s., & Sahoo, m. (2012). Lysozyme i boskap: En guide till urvalsforas. Journal of Animal Science Advances, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Lora och., & Wintjens, r. (2010). Strukturella förhållanden i lysozymsuperfamiljen: Betydande bevis för glykosidhydrolas -signaturmotiv. PloS en, 5(11), 1-10.
- « Oyamel -funktioner, livsmiljöer och distribution, användningar
- Kärnporegenskaper, funktioner, komponenter »

