Nuvarande atommodell

- 3354
- 511
- Karl Johansson
Vad är den nuvarande atommodellen?
han Nuvarande atommodell Det är den baserad på kvantmekanik, särskilt i Schrödinger -ekvationen, i principen om uteslutning av Pauli och en egenskap hos den elektron som heter snurra antingen Espin.
Det är modellen för största acceptans och användning i studien av strukturen hos atomer, molekyler och i den kemiska reaktiviteten hos elementen, på grund av precisionen av deras förutsägelser och deras relativa enkelhet.
 Figur 1. Väteatom i ett upphetsat tillstånd och dess atomnummer: Energi n = 4, vinkelmoment l = 3 och magnetiskt moment m = 1. Källa: Wikimedia Commons.
Figur 1. Väteatom i ett upphetsat tillstånd och dess atomnummer: Energi n = 4, vinkelmoment l = 3 och magnetiskt moment m = 1. Källa: Wikimedia Commons. Denna modell är utvecklingen av flera tidigare atommodeller, till exempel Rutherford -modellen och den för Bohr - Sommerfeld, betraktade klassiska eller halvklassiska modeller.
Det finns för närvarande teoretiskt mer kompletta modeller än Schrödingers typiska modell, till exempel Dirac-Jordan-modellen, som innehåller speciell relativitet och är baserad på Dirac Wave-ekvationen. I denna ekvation visas snurret, egenskapen hos de elektroner som nämns i början, naturligt.
Det finns också modeller baserade på kvantfältteori, tillämpade i högenergifysik. Dessa modeller är utmärkta för att förutsäga skapandet och förintelsen av grundläggande partiklar, målet för detta fysikfält.
Det är värt att nämna att de mest sofistikerade teorierna konvergerar till samma resultat som Schrödinger -ekvationen, särskilt för ljusatomer.
Nuvarande atommodellegenskaper
I visionen om den nuvarande atomen, baserat på icke-relativistiska kvantum, finns det inget begrepp om elektroniska banor i stil med planetsystem.
Den mest utbredda bilden av atomen är emellertid fortfarande den för en positiv central kärna och några negativa elektriska laddningsprickar (elektroner), vilket vänder sig till perfekt definierade banor runt den centrala kärnan. Men trots sina rötter motsvarar den inte längre den nuvarande atommodellen.
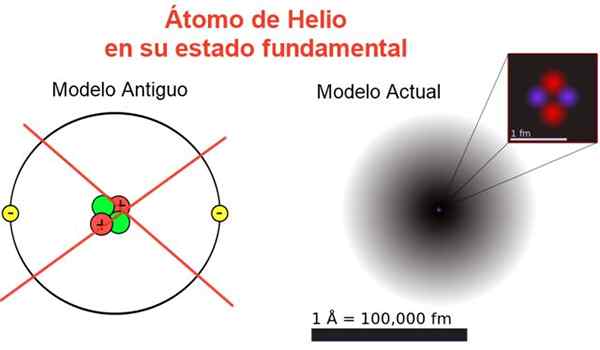 figur 2. Klassisk och aktuell bild av heliumatomen i dess grundläggande tillstånd. I den nuvarande modellen är de två elektronerna i heliumatomen spridda i en region som kallas orbital. Källa: Wikimedia Commons, din egen komposition.
figur 2. Klassisk och aktuell bild av heliumatomen i dess grundläggande tillstånd. I den nuvarande modellen är de två elektronerna i heliumatomen spridda i en region som kallas orbital. Källa: Wikimedia Commons, din egen komposition. Figur 2 visar den gamla bilden och den nuvarande bilden av en heliumatom i dess mindre energitillstånd (nivå n = 1 och l = 0).
Det kan tjäna dig: genomsnittlig acceleration: hur det beräknas och lösesDen klassiska bilden är användbar för att se att kärnan innehåller två protoner och två neutroner. Garanterar atomens neutralitet finns det två elektroner som upptar samma energinivå.
Från resten är det en bild bort från verkligheten, eftersom kärnan i kärnan inte ens motsvarar atomen: kärnan är 1/100000 gånger storleken på atomen, men det är där atommassan är koncentrerad.
Onda dualitet - partikel
Klassisk mekanik konstaterar att varje materialpartikel har en tillhörande våg, kallad Vågfunktion. Detta är det berömda Onda-partikelens dualitet från Louis de Broglie.
I den aktuella atommodellen är elektronens beteende i skalaen av atomerna framträdande böljande, medan på den makroskopiska nivån, såsom elektronerna som rör sig i katodstrålarören hos de gamla tv -apparaterna, dominerar det korpuskulära beteendet dominerar.
Å andra sidan, med fotoner, händer det tvärtom, i de flesta optiska fenomen (på makroskopisk nivå) har de grundläggande vågiga beteende. Och när de interagerar med materia ärenden har de ett partikelbeteende.
På grund av detta är elektroner runt kärnan spridda i områden som kallas atomorbitaler, vars form och förlängning beror på elektronernas energinivå och vinkelmomentet.
Både energi och vinkelmomentet för elektronen runt kärnan har vissa tillåtna värden, därför sägs det att de är kvantiserad.
Schrödinger -vågekvationen förutspår vilka energivärden och vinkelmoment som är tillåtna, liksom vågfunktionen associerad med varje energi och momentumnivå.
Vågfunktionens matematiska kvadrat bestämmer orbitalerna, det vill säga områdena runt kärnan där elektroner kan hittas mer troliga.
Atomstorleken
För att ha en skalabild av den aktuella atommodellen, låt oss föreställa oss att en atom har en diameter som en fotbollsplan. Kärnan skulle vara som en myra i mitten av fältet, men överraskande med 99,9% av atommassan.
Å andra sidan skulle elektroner vara lika diffusa spöklika spelare i hela fältet, med större sannolikhet för att hittas på mittfältet.
Kan tjäna dig: kategorisk variabel: egenskaper och exempelDet finns några anpassningar eller tillåtna sätt att ockupera fältet, som beror på spelare (elektroner) och mängden "vänd" eller snurr runt mitten.
Nuvarande atommodell postulerar
1.- Elektronen kännetecknas av dess massa m, av dess snurr s Och för att vara den elementära negativa lastbärarpartikeln (-e).
2.- Elektronerna har dubbelt, vågformat beteende, men beroende på deras energi och fenomenets skala kan vara mer övervägande än den andra.
3.- Elektronerna omger den positiva atomkärnan, så att de garanterar atomens elektriska neutralitet. Därför är mängden elektroner lika med protoner; Det här är atomnummer, som ger kemiska och fysiska egenskaper hos varje element.
4.- Interaktionen mellan elektroner och kärna modelleras av potentiell V (r) Coulombs elektrostatiska, som är införlivad i termen potentiell energi i Hamiltonian -operatören.
5.- Termen för kinetisk energi i Hamiltonian -operatören är en operatör som är byggd från den linjära momentumoperatören, som är densamma:
p = - i ħ ∂ /∂r
Där ħ är Plancks konstant dividerat med 2π.
6.- Den Hamiltoniska operatören H = (P⋅p)/2m - e v (r) agera på elektronvågfunktionen ψ (r).
7.- Eftersom de stationära lösningarna för den elektroniska vågfunktionen söks används den oberoende Schrödinger -ekvationen av tid:
H ψ (r) = E ψ (r)
Där E representerar elektronens totala energi.
8.- I atomer med flera elektroner beaktas inte interaktionen mellan dem.
9.- När det gäller atomer i många elektroner modelleras orbitalerna för de yttersta elektronerna av den skärmade kärnan av de mest inre elektronerna, som kallas Debye Potential.
10.- Ekvation (7) har en lösning för vissa diskreta energievärden, så att kändisar Hur många från Planck, De visas naturligtvis från Schrödingers ekvationslösningar.
Det kan tjäna dig: stationära vågor: formler, egenskaper, typer, exempelelva.- För varje diskret värde finns en vågfunktion. Men vissa lösningar degenereras, beroende på värdet på vinkelmoment l.
12.- Vågfunktionen är produkten från en radiell funktion, den azimutala funktionen och polarfunktionen.
13.- Denna vågfunktion bestämmer de tillåtna regionerna för elektronen. Vågfunktionens kvadrat är sannolikhetstäthet För att hitta elektronen i en viss position, sett från mitten av atomkärnan.
14.- Spinet visas inte i Schrödinger -ekvationen, men integreras i atommodellen genom Pauli -principen:
Elektronen är en fermion med två möjliga tillstånd av spin +½ och -½.
Så samma tillstånd som kännetecknas av kvantantal n, l, m i Schrödinger -ekvationen, kan ockuperas högst av 2 elektroner med motsatser motsatser motsatser. På detta sätt blir Espin det fjärde kvantantalet.
Influenentala forskare i den nuvarande atommodellen
Det verkar otroligt, men de flesta fysiker som bidrog till den nuvarande atommodellen visas på samma foto. De samlades på de berömda konferenserna sponsrade av Ernest Solvay, en kemist och industri av belgiskt ursprung, som blev berömd i vetenskapens värld.
De började hållas sedan 1911 och samlade de största forskarna för tillfället, bland dem var praktiskt taget alla som gav sitt bidrag till den nuvarande atommodellen.
Det mest kända av dessa konferenser hölls i Bryssel 1927 och där togs detta historiska fotografi:
 Figur 3. 1927 Solvay Conference -deltagare i Bryssel. Källa: Wikimedia Commons.
Figur 3. 1927 Solvay Conference -deltagare i Bryssel. Källa: Wikimedia Commons.  Figur 4. Deltagarna på Solvay 1927 -konferensen.
Figur 4. Deltagarna på Solvay 1927 -konferensen. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-temile
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Maxfödd
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Intresseartiklar
Schrödinger Atomic Model.
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Leucipo Atomic Model.
Bohr atommodell.
Referenser
- Alonso - Finn. Kvant- och statistiska grunder. Addison Wesley.
- Bauer, w. 2011. Fysik för teknik och vetenskap. Volym 1. MC Graw Hill.
- Eisberg och Resnick. Kvantfysik. Limusa - Wiley.
- Wikipedia. Atomteori. Återhämtad från: är.Wikipedia.com
- Zapata f. Typokuantisk modell av atomen. Hämtad från: Lifer.com

