Bros
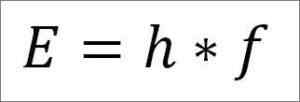
- 3624
- 507
- Hans Olsson
han Bros Det föreslogs av den franska fysikern Louis Broglie 1924. I sin doktorsavhandling sa Broglie att vågpartikelens dualitet hos elektroner, som lägger grunden för böljande mekanik. Broglie publicerade viktiga teoretiska resultat om våg-korpusculus natur.
Därefter demonstrerades Broglies uttalanden experimentellt av forskarna Clinton Davisson och Lester Germer, 1927. Wave Theory of the Broglie Electrons är baserad på Einsteins förslag om ljusens vågiga egenskaper i korta våglängder.
 Louis Broglie
Louis Broglie Broglie tillkännagav möjligheten att materien hade ett beteende som liknar ljuset och föreslog liknande egenskaper i subatomära partiklar som elektroner.
Elektriska och bana belastningar begränsar amplituden, längden och frekvensen för den våg som beskrivs av elektroner. Broglie förklarade rörelsen av elektroner runt atomkärnan.
[TOC]
Egenskaper för den atomiska modellen för Broglie
För att utveckla sitt förslag började Broglie från principen att elektroner hade en dubbel natur mellan våg och partikel, liknande ljus.
I den meningen gjorde Broglie en simil mellan de två fenomenen, och baserat på ekvationerna som utvecklats av Einstein för att studera ljusets böljande natur, sa följande:
- Den totala energin för foton och följaktligen elektronens totala energi är resultatet av produkten av vågfrekvensen och plankkonstanten (6 62606957 (29) × 10 -3. 4 Jules x sekunder), som beskrivs i följande uttryck:
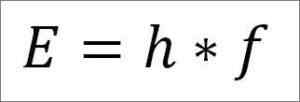
I detta uttryck:
E = elektronenergi.
H = plankkonstant.
F = vågfrekvens.
- Det linjära ögonblicket för fotonen och därför elektronen är omvänt proportionell mot vågens längd, och båda storlekarna är relaterade genom plankkonstanten:
Kan tjäna dig: omvänd osmos: hur det fungerar, vad är det för, exempel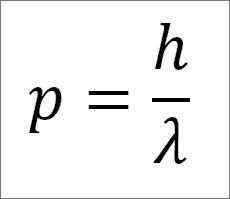
I detta uttryck:
P = linjärt ögonblick för elektronen.
H = plankkonstant.
λ = våglängd.
- Det linjära ögonblicket är produkten från partikelns massa på grund av den hastighet som nämnda partikel har under dess förskjutning.
Om det tidigare matematiska uttrycket omstruktureras beroende på våglängden är följande:
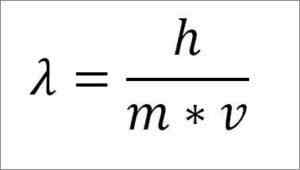
I det uttrycket:
λ = våglängd.
H = plankkonstant.
m = elektronmassa.
V = elektronhastighet.
Sedan h, plankkonstanten, har ett litet värde är våglängden λ också. Följaktligen är det möjligt att säga att elektronens vågegenskaper endast presenteras på atom- och subatomära nivåer.
- Broglie är också baserad på postulaten av Bohr Atomic -modellen. Enligt det senare är elektronernas banor begränsade och kan endast vara multiplar av hela siffror. Så:
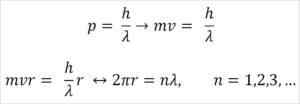
Var:
λ = våglängd.
H = plankkonstant.
m = elektronmassa.
V = elektronhastighet.
R = omloppsradie.
n = hela antalet.
Enligt Bohrs atommodell, till vilken Broglie antogs som bas, om elektronerna beter sig som stationära vågor, är de enda tillåtna banorna de vars radie är lika med en hel multipel av våglängden λ.
Därför uppfyller inte alla banor de nödvändiga parametrarna för en elektron att mobilisera genom dessa. Här är anledningen till att elektroner bara kan röra sig i specifika banor.
Vågteorin om Broglies elektroner motiverade framgången för Bohrs atommodell för att förklara väteatomens unika elektronbeteende.
Kan servera dig: torrt batteriPå samma sätt gav han också ljus på varför den här modellen inte anpassade sig till mer komplexa system, det vill säga atomer med mer än en elektron.
Davisson och Germer Experiment
Den experimentella kontrollen av den atomiska modellen för Broglie ägde rum 3 år senare efter publiceringen, 1927.
De framstående amerikanska fysikerna Clinton J. Davisson och Lester Germer bekräftade experimentellt teorin om böljande mekanik.
Davisson och Germer utförde spridningstester av en elektronstråle genom en nickelkristall och observerade fenomenet diffraktion genom den metalliska miljön.
Experimentet som genomfördes bestod av att utföra följande procedur:
- I första hand placerades en enhet med elektronstråle som hade en känd initial energi.
- En spänningskälla installerades för att påskynda elektronrörelsen som stimulerade en potentiell skillnad.
- Flödet av elektronstrålen till ett metallglas riktades; I det här fallet nickel.
- Antalet elektroner som träffade nickelglaset mättes.
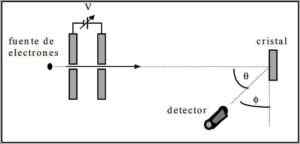
I slutet av experimentet upptäckte Davisson och Germer att elektronerna spriddes i olika riktningar.
Vid upprepning av experimentet med hjälp av metallkristaller med olika orienteringar upptäckte forskare följande:
- Dispersionen av elektronstrålen genom det metallglaset var jämförbart med fenomenet störningar och diffraktion av ljusstrålarna.
- Reflektionen av elektroner på Impact Glass beskrev banan som teoretiskt sett skulle beskriva enligt Broglie Electron Wave Theory.
Kort sagt, Davisson och Germer Experiment bevisade experimentellt den dubbla vågpartikelens natur hos elektroner.
Kan tjäna dig: polär kovalent länk: egenskaper och exempelBegränsningar
Broglies atommodell förutsäger inte den exakta platsen för elektronen på bana där den rör sig.
I denna modell uppfattas elektroner som vågor som mobiliseras i hela banan utan en specifik plats, som introducerar begreppet elektronisk bana.

Dessutom beaktar Broglies atommodell, analog med Schrödinger -modellen, inte rotationen av elektronerna på samma axel (snurra).
Genom att ignorera det inneboende vinkelmomentet för elektroner lämnas de rumsliga variationerna av dessa subatomära partiklar åt sidan.
I samma idéordning tar denna modell inte heller hänsyn till förändringarna i beteendet hos snabba elektroner till följd av de relativistiska effekterna.
Intresseartiklar
Schrödinger Atomic Model.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Leucipo Atomic Model.
Bohr atommodell.
Nuvarande atommodell.
Referenser
- Bohrs Quantum Theory och de Broglie Waves (S.F.). Återhämtat sig från: ne.Fysik.Kyushu-u.Växelström.J
- Louis de Broglie - Biografisk (1929). © Nobel Foundation. Återhämtat sig från: nobelpris.org
- Louis-Victor de Broglie (S.F.). Hämtad från: Chemed.Kem.Purdu.Edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Återhämtat sig från: Britannica.com
- De Broglie Atomic Model. National University of Distance Education. Spanien. Återhämtat sig från: ocw.Innova.Uned.är
- Louis de Broglie.F.). Återhämtat sig från: hiru.Eus
- Von Pamel, eller., Och Marchisio, s. (s.F.). Kvantmekanik. National University of Rosario. Återhämtat sig från: fceia.a r.Edu.ar

