Dalton Atomic Model

- 2117
- 465
- Erik Eriksson
Vi förklarar Daltons atommodell, hans postulat och begränsningar
 Daltons atommodell var den första som baserade sig på vetenskaplig forskning. Källa: f. Zapata.
Daltons atommodell var den första som baserade sig på vetenskaplig forskning. Källa: f. Zapata. Vad är Daltons atommodell?
han Dalton Atomic Model Den föreslår att all materia består av små och odelbara enheter, kallade atomer och därmed återta de idéer som tidigare grekiska tänkare hade formulerat för två tusen år sedan.
Det är den första atommodellen som kom ut från ett noggrant experiment i laboratoriet, för även om mänskligheten alltid har försökt förstå vilken fråga som är, fram till det tidiga 1800 -talet, möjligheterna att experimentellt verifiera teorierna var fortfarande begränsade.
Förutom att vara en god naturobservatör stod emellertid den engelska läraren John Dalton (1766-1844) också ut inom instrumentfältet, eftersom han skapade flera mätanordningar, som han senare skulle använda i sitt laboratorium för studien av studien gaser.
Således insåg Dalton att ämnen kombineras efter vissa regler, och för att förklara det antydde han att all materia var sammansatt av atomer, små, homogena sfärer och saknar intern struktur. Atomer, sade han, bildar föreningar efter vissa proportioner, och under en kemisk reaktion separerar de och kombinerar igen och skapar nya föreningar.
Dalton utvecklade inte bara den första atommodellen baserad på rigorös experiment. Han skapade också ett nomenklatursystem för elementen, beordrade dem för deras atomvikt, etablerade lagen om flera proportioner, lagen om partiellt tryck och beskrev blindhet för vissa färger, ett tillstånd som han själv lidit, kallade färgblindhet.
Hans omfattande bidrag till vetenskapen tjänade många distinktioner under sin vetenskapliga karriär, men Dalton levde alltid på ett blygsamt och enkelt sätt, tillägnad vetenskap fram till slutet av hans dagar.
Kort historia
Sedan avlägsna tider har mänskligheten sökt en förklaring om materiens natur. Grekiska tänkare från 500 -talet.C, och innan de, några hinduiska filosofer, antydde att saken bestod av elementära enheter som kallas atomer. De saknade emellertid det nödvändiga experimentella stödet för att verifiera sina teorier.
Kan tjäna dig: Vilka är de termiska egenskaperna och vad är det? (Med exempel)Den första atommodellen tillskrivs Leucipo och hans Democritus Disciple of Abdera (460 till. C. - 370 a. C.). Från det första lilla är det känt, men Democritus var en visare av stor känd, jämförbar med Platon och Aristoteles, även om några fragment av hans arbete knappt bevaras.
Democritus utformade atomen som den ultimata partikeln som bildar saken, odelbar och oförstörbar. Enligt deras teorier bestod all materia av dessa partiklar, för små för att ses. Och enligt sättet att kombinera tillhandahöll atomer ämnet deras karakteristiska egenskaper.
I motsats till detta, efter kommentering. Aristoteles kontinuerliga idéer rådde äntligen fram till början av 1800 -talet.
Daltons verk
1793 var John Dalton intresserad av meteorologi och fortsatte att arbeta i studien av atmosfäriska gaser och deras egenskaper. Tack vare sina experiment insåg han att element som syre, alltid kombinerade i en viss andel, ges av ett heltal.
År 1803 förklarade Dalton att dessa proportioner beror på att saken består av grundläggande partiklar, kallade atomer, som demokrit sa för länge sedan. Han presenterade sitt förslag i arbetet "nya system för kemisk filosofi", där han beskrev resultaten från sina experiment.
Dessutom inkluderade i detta arbete också speciella symboler för att representera de enskilda atomerna i varje element och därmed lägga grunden för modern kemi.
Kan tjäna dig: akuta ljud: egenskaper och exempelFörklaring av Dalton Atomic Model
Under den tid då Dalton utvecklade sitt arbete hade andra forskare redan upptäckt några av de lagar som styr ämnet och kombinationerna mellan elementen: Antoine Lavoisier konstaterade att massan under en kemisk reaktion inte skapas eller förstörs, men som blir.
Denna lag följdes av Prousts lag om de definierade proportionerna och fastställde att när två element kombineras gör de det alltid i fasta proportioner.
Nu bestod en del av Daltons experiment av att studera absorptionen av vatten i vattnet. Där observerade han att en viss volym vatten bara kunde absorbera viss mängd gas och att den mängden varierade beroende på gasen. Dessutom kunde gas återvinnas från vatten och hålla sina egenskaper intakt.
Han hade också upptäckt att när två element kan kombineras för att komma från mer än en förening, förblir mängden av var och en fast och håller en enkel numerisk relation, till exempel 1: 1, 1: 2; 2: 3 och så vidare. Detta är samtalet Lag i flera proportioner.
För att förklara dessa fakta hävdade Dalton att gas, vatten och i allmänhet, alla ämnen, består av grundläggande bitar, som, när de kombineras, ger upphov till olika föreningar. Varje element består av distinkta partiklar (Dalton kallade dem inte atomer i början), men även i kombination upprätthåller sådana partiklar sina oförändrade egenskaper.
Daltons atommodell postulerar
Daltons atommodell sammanfattas i följande uttalanden:
1. Materien består av små odelbara partiklar som kallas atomer.
2. Varje element består av identiska atomer med varandra och med lika egenskaper. Atomerna i ett element skiljer sig från andras.
3. Genom att gå med två eller flera atomer av olika element gör de det i vissa och enkla proportioner och skapar således föreningarna, bildade av molekyler. Molekylerna för en viss förening är identiska med varandra.
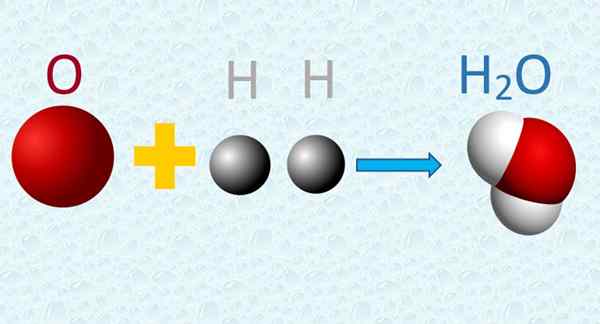 I en vattenmolekyl kombineras syre- och väteatomer i enkla proportioner. Källa: f. Zapata.
I en vattenmolekyl kombineras syre- och väteatomer i enkla proportioner. Källa: f. Zapata. 4. Under en kemisk reaktion byts atomer, men de lider inte av någon omvandling, och de skapas inte heller eller förstörs i processen.
Dalton -modellfel
Vetenskaplig forskning upplevde en anmärkningsvärd boom under det nittonhundratalet, främjat av den industriella revolutionen. Och de viktigaste misslyckandena i Daltons atommodell avslöjades inte:
Kan tjäna dig: gränsytespänning: definition, ekvation, enheter och mätning1. Atomen är inte odelbar
Detta är ett av de viktigaste misslyckanden i Daltons atommodell. Experimenten som genomfördes under de nittonde och tjugonde århundradena visade att atomen består av en mängd subatomära partiklar.
Den första som kände varandra var elektronen och protonen, och senare lärde det sig om neutronens existens. Sedan avslöjade både protonen och neutronen sin inre struktur.
2. Atomer av samma element kanske inte är identiska
Elementen har isotoper att även om de har samma kemiska egenskaper, skiljer sig åt i antalet neutroner, så deras atomvikt är annorlunda. Till exempel är väteisotoper protio, deuterium och tritium.
3. Atomer är inte oundvikliga
Det finns radioaktiva ämnen som avger partiklar och energi som förvandlas till andra element.
4. Atomer kombineras inte alltid i hela proportioner
Det är bevisat att det finns organiska, mer komplexa föreningar, som inte följer exakt Daltons lag om flera proportioner.
Intresseartiklar
Schrödinger Atomic Model.
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Leucipo Atomic Model.
Bohr atommodell.
Rutherford Atomic Model.
Nuvarande atommodell.

