Schrödinger Atomic Model
- 4385
- 1209
- Anders Larsson
Vad är Schrödingers atommodell?
han Schrödinger Atomic Model Det är ett förslag till operationen och strukturen för atomen som utvecklats av Erwin Schrödinger 1926. Det är känt som Atoms kvantmekaniska modell och beskriver elektronens vågbeteende.
För detta baserades den enastående österrikiska fysikern på Broglie -hypotesen, som uppgav att varje rörlig partikel är associerad med en våg och kan bete sig som sådan.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger föreslog att rörelsen av elektroner i atomen motsvarade vågpartikeldualiteten, och följaktligen kunde elektronerna mobilisera runt kärnan som stationära vågor.
Schrödinger, som tilldelades Nobelpriset 1933 för sina bidrag till atomteori, utvecklade den homonyma ekvationen för att beräkna sannolikheten för att en elektron kommer att vara i en specifik position.
Schrödinger atommodellegenskaper
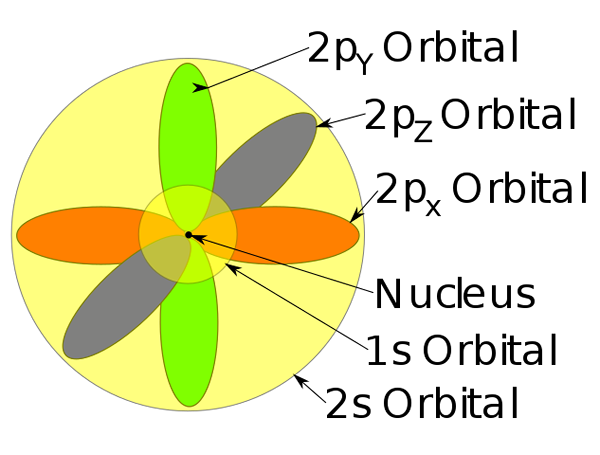 Orbital 1s, 2s och 2p inuti en natriumatom.
Orbital 1s, 2s och 2p inuti en natriumatom. -Denna atommodell beskriver rörelsen av elektroner som stationära vågor.
-Elektronerna rör sig ständigt, det vill säga de har inte en fast eller definierad position inom atomen.
-Denna modell förutsäger inte elektronplatsen och beskriver inte heller den rutt den gör inom atomen. Upprättar bara en sannolikhetszon för att hitta elektronen.
-Dessa sannolikhetsområden kallas atomiska orbitaler. Orbitalerna beskriver en översättningsrörelse runt atomens kärna.
-Dessa atomiska orbitaler har olika nivåer och energiundervelar och kan definieras mellan elektronmoln.
-Modellen överväger inte stabiliteten i kärnan, den hänvisar bara till att förklara kvantmekaniken som är förknippad med rörelsen av elektroner i atomen.
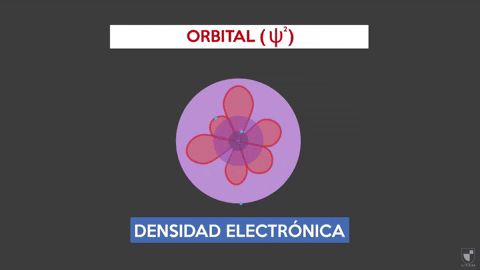 Elektronisk densitet indikerar sannolikheten för att hitta en elektron nära kärnan. Den närmare kärnan (lila zonen) kommer det att bli mer sannolikhet, medan det blir mindre om du flyttar bort från kärnan (violetta området).
Elektronisk densitet indikerar sannolikheten för att hitta en elektron nära kärnan. Den närmare kärnan (lila zonen) kommer det att bli mer sannolikhet, medan det blir mindre om du flyttar bort från kärnan (violetta området). Experimentera
Schrödingers atommodell är baserad på Broglie -hypotesen, liksom de tidigare atommodellerna av Bohr och Sommerfeld.
Kan tjäna dig: dynamisk eller kinetisk friktion: koefficient, exempel, övningarBroglie föreslog att precis som vågor har partiklar har partiklar vågegenskaper, med en tillhörande våglängd. Något som genererade mycket förväntningar vid den tiden och var Albert Einstein själv vid sin teori.
Broglies teori hade emellertid en brist, vilket var att betydelsen av egen idé inte förstods särskilt bra: en elektron kan vara en våg, men hur är det med vad? Det är när figuren av Schrödinger verkar svara.
För att göra detta förlitade sig den österrikiska fysikern på Youngs experiment, och baserat på hans egna observationer utvecklade han det matematiska uttryck som bär hans namn.
Därefter de vetenskapliga grunderna för denna atommodell:
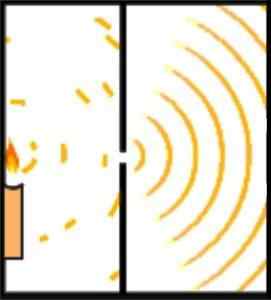
Youngs experiment: den första demonstrationen av vågpartikeldualitet
Broglies hypotes om ämnets böljande och korpuskulära natur kan demonstreras av Youngs experiment, även känd som dubbel slitsexperiment.
Den engelska forskaren Thomas Young lade grunden till Schrödingers atommodell när han 1801 genomförde experimentet för att verifiera ljusets böljande natur.
Under sitt experiment delade Young utsläppet av en ljusstråle som korsar ett litet hål genom en observationskammare. Denna uppdelning uppnås genom att använda ett 0,2 millimeterkort, beläget parallellt med strålen.
Utformningen av experimentet gjordes för att ljusstrålen skulle vara bredare än kortet, vilket placerade kortet horisontellt, strålen delades upp i ungefär samma delar. Ljustrålarnas utgång leddes av en spegel.
Kan tjäna dig: distanskrafterBåda ljusstrålarna träffar en vägg i ett mörkt rum. Där bevisades störningsmönstret mellan de två vågorna, vilket visades att ljuset kunde bete sig lika mycket som en partikel och en våg.

Ett sekel senare förstärkte Albert Einsten idén genom kvantmekanikens principer.
Schrödingers ekvation
Schrödinger utvecklade två matematiska modeller, och skilde sig till vad som händer beroende på om kvanttillståndet förändras över tid eller inte.
För atomanalys publicerade Schrödinger i slutet av 1926.
Detta innebär att vågen inte rör sig, dess noder, det vill säga dess jämviktspunkter, fungerar som en pivot för resten av strukturen att röra sig runt dem, och beskriver en viss frekvens och amplitud.
Schrödinger definierade vågorna som beskriver elektroner som stationära eller omloppstillstånd och är i sin tur associerade på olika energinivåer.
Schrödingers oberoende tidsekvation är som följer:
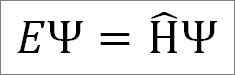
Var:
OCH: Proportionalitetskonstant.
Ψ: Kvantsystemvågfunktion.
Η ̂: Hamiltonian operatör.
Schrödingers oberoende tidsekvation används när det observerbara som representerar systemets totala energi, känd som Hamiltonian Operator, beror inte på tiden. Men funktionen som beskriver den totala vågrörelsen kommer alltid att bero på tid.
Schrödingers ekvation indikerar att om du har en vågfunktion ψ och den Hamiltoniska operatören verkar på den, är proportionalitetskonstanten och representerar kvantsystemets totala energi i ett av dess stationära tillstånd.
Det kan tjäna dig: diskret variabel: egenskaper och exempelTillämpas på Schrödingers atommodell, om elektronen rör sig i ett definierat utrymme, finns det diskreta energivärden, och om elektronen fritt skiftas i rymden, har kontinuerliga energiintervaller haft.
Från den matematiska synvinkeln finns det flera lösningar för Schrödinger -ekvationen, varje lösning innebär ett annat värde för proportionalitetskonstanten och.
Enligt Heisenbergs osäkerhetsprincip är det inte möjligt att uppskatta positionen eller energin för en elektron. Följaktligen inser forskare att uppskattningen av elektronplatsen i atomen är felaktig.
Postulat av Schrödinger Atomic Model
Postulaten för Schrödinger atommodell är följande:
-Elektronerna beter sig som stationära vågor som distribueras i rymden enligt vågfunktionen ψ.
-Elektronerna rör sig inuti atomen som beskriver orbitaler. Det här är områden där sannolikheten för att hitta en elektron är betydligt högre. Den ovannämnda sannolikheten är proportionell mot kvadratet för vågfunktionen ψ2.
Den elektroniska konfigurationen av Schrödinguer -atommodellen förklarar de periodiska egenskaperna hos atomer och länkar som bildas.
Schrödingers atommodell överväger emellertid inte spinnet av elektroner och överväger inte variationerna av snabba elektroner på grund av relativistiska effekter på grund av relativistiska effekter.
Intresseartiklar
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Leucipo Atomic Model.
Bohr atommodell.
Sommerfeld Atomic Model.
Nuvarande atommodell.
Referenser
- Den kvantmekaniska modellen för atomen återhämtade sig från: den är.Khan akademin.org
- Schrödingers vågekvation (S.F.). Jaime I University. Castellón, Spanien. Återhämtat sig från: uji.är
- Modern atomteori: Modeller. © ABCTE. Återhämtat sig från: abcte.org
- Schrodingers atommod.F.). Återhämtat sig från: Erwinschrodingerbiografi.Liten.com
- Wikipedia, fri encyklopedi. Schrödinger -ekvation. Återhämtad från: är.Wikipedia.org
- Wikipedia, fri encyklopedi. Unga experiment. Återhämtad från: är.Wikipedia.org

